
As origens da química são quase tão antigas como a humanidade. As primeiras actividades "pré-químicas" indubitavelmente consistiam em algumas poucas observações casuais. As criaturas da idade da pedra provavelmente maravilharam-se com o modo pelo qual um pedaço de madeira se transforma quando era consumido pelo fogo, as transformações no aspecto, cheiro e gosto de um pedaço de carne que se deterioram e as transformações na cor e consistência de um pedaço de argila cozida próxima do fogo.
O que é a química?
Antigamente, era fácil definir química. A definição tradicional soava alguma coisa como isto: a química é o estudo da natureza, propriedades e composição da matéria e como esta sofre alterações. Esta serviu como uma definição perfeitamente adequada até 1930 quando a ciência natural (o conhecimento sistemático da natureza) parecia divisível nitidamente em ciências físicas e biológicas: as primeira compreendendo a física, a química, a geologia e a astronomia e a última constituída pela botânica e zoologia. Esta classificação é ainda usada. Porém, o aparecimento de campos importantes de estado, como a oceanografia, paleobotânica, meteorologia e bioquímica, por exemplo, mostrou cada vez mais claramente que as linhas divisórias entre as ciências não são absolutamente nítidas. A química, por exemplo, sobrepõe-se, tanto com a geologia (assim nós temos a geoquímica ), como com a astronomia (astroquímica) ou a física (físico-química ). Daí a impossibilidade de se conceber uma definição moderna, realmente boa de química, excepto, talvez recorrendo à definição operacional: química é o que os químicos fazem.
Porquê estudar química?
A química representa uma parte importante em todas as outras ciências naturais, básicas e aplicadas. O crescimento e o metabolismo das plantas, a formação das rochas ígneas, o papel desempenhado pelo ozono na atmosfera superior, a degradação dos poluentes ambientais, as propriedades do solo lunar, a acção medicinal de drogas: nada disto pode ser compreendido sem o conhecimento e as perspectivas fornecidos pela química. De facto, as pessoas estudam química a fim de poderem aplicá-la nas áreas particulares de interesse.
Sem dúvida, a química em si é também a área de interesse de muitas pessoas. Muitos estudam a química não para explicá-la a outra área, mas simplesmente para aprender, de um ponto de vista químico, mais sobre o mundo físico e o comportamento da matéria . Alguns apreciam "o que os químicos fazem" e assim decidem fazer o mesmo.
Bibliografia:
Russel, B.J. - Química Geral
Editora McGraw - Hill do Brasil
1982 Brasil
Idalina Ferreira e Marta carvalho
(12º Ano - Esc.Sec.Barcelinhos)
Para além de sintetizarmos gorduras no nosso próprio organismo, comemos gorduras sintetizadas em plantas ou animais; elas constituem uma das três principais classes de alimentos, sendo as outras os hidratos de carbono e as proteínas. As gorduras são também muito utilizadas, em quantidades enormes, como matérias-primas, em muitos processos industriais.
A manufactura do sabão constitui uma das sínteses químicas mais antigas, usadas pelo homem. (Menos antiga, evidentemente que a produção de álcool etílico; os anseios de limpeza do homem são, na verdade, muito mais recentes do que os seus desejos de estimulação alcoólica!).
Ao ferverem o sebo de cabra com a lixívia potássica, feita com as cinzas de madeira, as tribos germânicas, contemporâneas de César, estavam a utilizar a mesma reacção química que os fabricantes de sabão modernos efectuam numa escala enorme: a hidrólise dos glicéridos. A reacção dá origem aos sais dos ácidos carboxílicos e ao glicerol.
O sabão ordinário dos nossos dias é simplesmente uma mistura de sais de sódio de ácidos gordos de cadeia longa. É uma mistura, porque a gordura a partir da qual ele se prepara é uma mistura e porque para a lavagem do corpo, ou da roupa, uma mistura serve tão bem como um único sal puro.
O sabão pode variar segundo a composiçao e segundo o método de fabricação: se preparado a partir do azeite, tem-se o sabão de Marselha; pode adicionar-se-lhe álcool para o tornar transparente; por batimento pode incorporar-se-lhe ar e dar-lhe a propriedade de flutuar; podem adicionar-se-lhe perfumes, corantes e germicidas; se utilizar o sal de potássio (em vez do sódio), tem-se o sabão mole. Quimicamente, porém, o sabão permanece essencialmente o mesmo e actua do mesmo modo.
Um subproduto da manufactura de sabões é a glicerina, da qual se pode obter a citroglicerina, poderoso explosivo. Durante a 1ª e 2ª Guerras Mundiais, as donas-de-casa guardavam o excesso de óleos e gorduras de cozinha e devolviam para recuperação de glicerina.
Em princípio seria se esperar que estes sais fossem solúveis em água, e, na verdade, pode preparar-se o que se chama "soluções de sabão". Nao se trata, todavia, de verdadeiras soluções, em que as moléculas do soluto se movem livremente, e independentemente uma das outras, por entre as moléculas do solvente. O que acontece é que o sabão se dispersa em agregados esféricos ou cilíndricos denominados micelas, cada um dos quais pode conter centenas de moléculas de sabão.
Uma molécula tem uma extremidade polar, e uma não polar, constituída por uma longa cadeia carbonada com 12 a 8 carbonos. A extremidade polar é solúvel em água e diz-se que é hidrofila (que gosta de água). A não-polar é insolúvel em água e diz-se hifrófoba mas é, evidentemente, solúvel em solventes apolares. Moléculas como estas dizem-se anfipáticas, têm extremidades polares e apolares e, além disso, são suficientemente grandes para que cada extremidade apresente o seu comportamento próprio, quanto à solubilidade.
De acordo com a regra "polar dissolve polar, apolar dissolve apolar", a extremidade apolar procura um ambiente apolar; ora, em meio aquoso, o único ambiente deste tipo existente sao as partes apolares das outras moléculas do sabão, e daí que elas se anichem juntinhas no interior da micela. As extremidades polares dispôem-se à periferia do agregado, voltadas para o solvente polar, a água. Os grupos carboxilato, carregados negativamente, ouriçam-se à superficie da micela e esta aparece rodeada de uma atmosfera iónica constituída pelos catiões do sal. A repulsão entre cargas do mesmo sinal mantém as micelas dispersas.
Mas então, como é que o sabão lava? O problema, na lavagem, reside na gordura e óleo que entram na constituição da sujidade. A água, por si só, não pode dissolver estas substâncias hidrófobas; as gotículas do óleo, por exemplo, em contacto com a água tendem a coalescer (aglutinar-se umas às outras) e daí o formar-se uma camada aquosa e uma camada oleosa. A presença do sabão, porém, altera esta situação. As partes não-polares das moléculas do sabão dissolvem-se nas gotículas do óleo, deixando as extremidades de carboxilato projectar-se na camada aquosa circundante. A repulsão entre cargas do mesmo sinal impede agora as gotículas do óleo de coalescerem; forma-se assim uma emulsão estável de óleo em água, que é facilmente removida da superfície que se pretende limpar.
O sabão, mistura de sódio e de ácidos gordos de cadeia longa, são ineficientes em água dura, que contém sais de cálcio e magnésio que, reagindo com o sabão, formam carboxilatos de cálcio e magnésio "crosta" que aparece na banheira após o banho); isto reduz fortemente a sua eficácia detergente.
Por outro lado, os sais de cálcio e de ferro de hidrogeno-sulfatos de alquila são solúveis em água, e os sais de sódio destes materiais conhecidos como detergentes, são eficientes mesmo em água dura. Estes detergentes contêm cadeias alquídias lineares como as gorduras naturais. Como são metabolizados por bactérias nas estações de tratamentos de esgotos, chamam-se detergentes biodegradáveis.
BIBLIOGRAFIA:
- Allinger; Cava; De Jongh; Johnson; Lebel; Stevens "Química
Orgânica" - 2° Volume - Editora Guanabara
- R. Morrison; R. Boyd - "Química Orgânica" - Fundação Calouste Gulbenkian - 1996
Rosária Maria Saraiva
(12º Ano - Esc.Sec.Barcelinhos)
Uma das ciências que mais tem contribuído para
a vida que temos actualmente é sem dúvida a Química.
Esta, é pois a ciência que está mais
directamente relacionada com o nosso dia-a-dia, ela permeia de
forma fascinante e central a nossa vida quotidiana.
A Química contribui decisivamente para a melhoria
da qualidade de vida das pessoas, de tal forma que, tudo em nosso
redor pode ser considerado um produto da Química: o papel
em que escrevemos, os alimentos que ingerimos, os lápis
e as canetas com que escrevemos, os automóveis em andamos
e tantos outros.
Pode dizer-se que o mundo gira devido à Química
e são muito vastos os domínios de aplicação
desta ciência: na medicina, na indústria, na agricultura
e até mesmo na criminologia com a utilização
de processos químicos, para obtenção de provas.
No entanto o desenvolvimento tecnológico não
nos tem trazido só bem estar e conforto. Os riscos estarão
sempre presentes!
Basta pensarmos: na poluição das águas
que bebemos, do ar que respiramos e do solo de onde provém
a nossa alimentação; no lixo que produzimos, algum
do qual não é biodegradável; na destruição
da camada do ozono, originada pelo abuso dos aerossóis
e outras substâncias; nos desastres ecológicos que
têm acontecido...
O desenvolvimento até agora tem sido como ìreverso
da medalhaî a consequente degradação ambiental
mas, o Homem criou já um grande número de regras
que devem ser cumpridas para que o controlo da poluição
seja possível.
Prata nos pára-brisas
Talvez não saibas que os pára-brisas de muitos
automóveis têm à superfície uma finíssima
e invisível camada de prata por onde circula uma corrente
eléctrica, libertando calor suficiente para fundir o gelo
e a neve que sobre eles se vão depositando durante a viagem.
Chás
O chá é uma das mais famosas e antigas bebidas,
tanto no Oriente como no Ocidente. Pode ser chá preto e
chá verde, o preto obtém-se por fermentação
do chá verde .
O chá é rico em ião fluoreto (o chá
verde é duas vezes mais rico do que o chá preto)
bastando uma simples chávena para fornecer o fluoreto necessário
a uma dentição saudável. Contém também
cafeína, embora em menor quantidade do que o café.
O efeito dos gases de escape
Será que conheces o efeito dos gases de escape ?
No ambiente contribuem para o aumento da concentração
de dióxido de carbono (CO2); para a formação
de chuvas ácidas ( o que provoca morte de microrganismos,
plantas, culturas de certas habitações); para a
formação da poluição fotoquímica
(o que provoca reacções na alta atmosfera, diminuindo
a camada de ozono).
Na saúde o CO (monóxido de carbono) interfere na
absorção do Oxigénio pela hemoglobina, provocando
dores de cabeça e vertigens, perda de equilíbrio
e problemas visuais e auditivos.
Os óxidos de carbono (NO) provocam sobretudo problemas
ao nível do aparelho respiratório, o chumbo (Pb)
afecta os sistemas respiratório, nervoso e reprodutivo.
Provoca hipoactividade e dificuldades de aprendizagem nas crianças.
O dioxido de enxofre (SO2) provoca a asma, bronquite e equisemas.
Provoca tosse e prejudica as funções pulmonares.
Cocaína ao desbarato
Sabias que nos Estados Unidos da América a cocaína
anda espalhada pelas notas....Tal conclusão só foi
possível devido aos modernos métodos de análise
físico-química, que são capazes de analisar
quantidades cada vez menores de substâncias.
Praticamente todas as notas de um a cem dólares contem
vestígios de cocaína, que vão de 2mg a 0,25
mg ! A razão é a utilização das notas
como papel de embrulho para pequenas doses de droga e a improvisação
de tubos de papel como recipientes de aspiração
(sniffings tubes).
Os químicos e o combate à poluição
Talvez não saibas que os químicos, acusados muitas
vezes de agressores do ambiente, se preocupam com ele mais do
que a maioria dos cidadãos.
Os químicos da conhecida marca inglesa de fósforos
Bryant & May verificaram que o simples acto de riscar um fósforo
contribui para lançar na atmosfera mais dióxido
de enxofre. Por esta razão decidiram fazer fósforos
ìmais verdesî, substituindo o enxofre (um dos componente
usuais da cabeça do fósforo, aliado ao clorato de
potássio, cola e outros) por um composto de fósforo
e ferro, o ferrofósforo, que ao ser riscado desenvolve
calor e inflama os vapores de fósforo produzidos, dando
óxidos de fósforo, que não são voláteis.
BIBLIOGRAFIA
- CORRÊA, Carlos, e outros, Química 11º Ano,
Porto Editora, Porto
- SERRÂO, Maria Eleonor, e outros, Física Química
8º Ano, 1ª Edição, Constância.
Lúcia Faria
(12º Ano - Esc.Sec.Barcelinhos)
Curiosidades e Descobertas.
 |
Se gostas de Química, acompanha-me e descobre algumas das mais incríveis curiosidades !! |
|
Um kiwi amadurece mais depressa junto a uma banana ou a uma maçã do que sozinho. Qual a explicação? Há etileno no amadurecimento dos frutos: a banana e a maçã maduras libertam etileno que faz amadurecer o kiwi. |
 |
 |
Por que é que o cabelo molhado é mais fácil de pentear? A açcão da água quebra as ligações de Hidrogénio e, por isso, o cabelo molhado é fácil de pentear. Assim, também depois de seco fica penteado porque se restabelecem aquelas ligações. |
Indicadores caseiros
| Por
vezes, ocorrem mudanças de cor em situações
inesperadas. Porquê? Embora nem sempre se pense, ocorrem com frequência reacções ácido-base. Por exemplo, quando cai chá líquido na banca da cozinha que contém vestígios de detergente, o chá torna-se esverdeado. O arroz de bróculos tem uma cor arroxeada; quando misturado com uma salada temperada com vinagre a cor muda para rosa. Além dos bróculos e do chá, beterrabas, amoras ou vinho são também indicadores caseiros |
 |
Ovo numa garrafa
Um ovo cozido, descascado,
é colocado sobre o gargalo de uma arrafa grande. Numa questão
de segundos, o ovo é arrastado para o interior da garrafa.
A garrafa é virada ao contrário e o ovo volta a
sair quando se sopra junto ao gargalo da garrafa. Porquê?
A água quente aquece a garrafa e o ar que se encontra
no seu interior. Quando se coloca o ovo no gargalo, o ar dentro
da garrafa fica isolado do ar exterior, o que faz diminuir a pressão
no interior da garrafa à medida que a ternperatura do ar
no interior vai baixando. A pressao no exterior da garrafa (pressao
atmosférica) é superior à interior
e "empurra" o ovo para dentro da garrafa. Quando se
sopra para o interior da garrafa, a pressão interior torna-se
superior à exterior fazendo sair o ovo.
[Baseado em Denonstrações
de Químiica de Lee. R, Summerlin
Christie L. Brorgford, Julie B. Ealy.]
______________________
A Química e a banda desenhada
Ao ler as aventuras
do Astérix encontra-se uma interessante curiosidade: Cleópatra,
a famosa rainha egípcia, mandava no séc. I a. c.
(na época do seu reinado), colocar pérolas no vinagre
que tomava para a sua dieta. Porquê?
Ao colocar pérolas o carbonato de cálcio
reduzia a sua acidez. Ainda hoje, o calcário - substância
básica- utiliza-se para regular a acidez de alguns solos
Pneus dão sola para
sapatos
"O pneu careca que os teus pais substituiram, há
pouco, pode acabar nos teus pés! Sapatos feitos de pneus
reciclados, testados nos E.U.A., estão à venda na
Europa aproveitando as grandes quantidades de pneus gastos. Nao
só as solas são feitas de pneus reciclados como
o sapato é colado com cola não tóxica e a
pele tratada por um processo de tintas vegetais. Até as
embalagens têm este esprito de reciclageml': as caixas
são de papel e cartão reciclados e pintados com
a tinta de água." (Traduzido e adaptado de Chemecology,
vol.22, nº3, 199)
A Químíca
e os espiões alemães
Na 2ª Guerra Mundial, os espiões alemães
transmitiam mensagens secretas escritas com solução
incolor de nitrato de chumbo.
A revelação era feita com sulfureto de sódio
através da reacção:
Pb2+ (aq)
+ S2-
(aq) -> PbS (s)
aparecendo as palavras em negro, a cor do sulfureto de
chumbo.
O Magnésio e a metereologia
Na 2ª Guerra Mundial, usou-se a reacção
do magnésio com água quente para produzir hidrogénio
com que se enchiam os balões de metereologia.
As plantas e o sal
Todas as plantas contém sal. Em países africanos
distantes do mar e de minas de sal gema obtem-se sal a partir
de cinzas de plantas. O sal é separado das outras
substâncias dissolvidas em água.
Um carburante vegetal
| A fermentação e destilação
de açúcares vegetais permite obter etanol. O etanol
pode ser obtido também a partir da cana do açúcar,
mandioca, hupinambos, milho,... Queres experimentar? Executa o seguinte procedimento: 1º - Lavar e descascar algumas beterrabas; 2° - Ralar. Juntar água; 3° - Macerar e filtrar. Inicia-se a fermentação. 4°- Ao fim de 2 ou 3 semanas destilar. Obtém-se álcool que pode fazer funcionar um motor a gasolina. |
 |
Cabelo e ph
Porque é que certos depilatórios são
fortemente alcalinos? O ph determina características importantes
do cabelo: num meio húmido de ph = 4 a 5 torna-se mais
forte, a ph=3,5 fica espigado e a ph=12 dissolve-se. Assim, em
meio alcalino fica mais suave e os depilatórios são
mais eficazes.
Azoto e oxigénio:
origem e descoberta
O azoto teve origem na desgasificação das
rochas, foi descoberto em 1772 pelo químico, botânico
escocês Daniel Rutherford.
O Oxigénio foi descoberto em 1774 pelo químico sueco
K.W. Scheele e pelo químico inglês J. Priestley.
A era dos objectos de plástico
A era dos objectos de plástico (tupperware) começou
com o fabrico de um copo de polietileno por Tupper nos E.U.A.,
em 1941
O fabrico de sabão
Fabrica-se sabão há mais de 4500 anos, pela
reacção química:
C3(CH2)16 CO2H
+ NaOH -->
C3(CH2)16 CO2Na+
+ H2O
A maior molécula
de hidrocarboneto
A maior molécula de hidrocarboneto sintetizada até
hoje tem a fórmula química:
C139H127
Quais os melhores bioindicadores
de chuvas ácidas?
Certos líquenes são tão sensíveis
ao dióxido de enxofre na atmosfera que constituem os melhores
indicadores de chuvas ácidas.
Bibliografia:
Química, Da a Dia - Gil, M.S.Victor,
Plátano Editora.
Fátima Fonseca
(12º Ano - Esc.Sec.Barcelinhos)
Tudo no Universo - metais, estrelas, alimentos, o ar que respiramos e nós próprios - é feito de combinações de apenas algumas dezenas de elementos químicos diferentes. Estes, por sua vez, derivam apenas de três tipos diferentes de partículas subatómicas: protões, neutrões e electrões, formando assim o átomo.
Os átomos são "grãos" de matéria muitíssimo pequenos, que podem participar numa combinação química. Sendo assim tão pequenos que é impossível vê-los com microscópios vulgares
 |
Fig.1 Modelo atómico de Thomson |
Cada átomo de um elemento é constituído por um núcleo denso rodeado por uma nuvem difusa de electrões.
Os protões e os neutrões agrupam-se no centro do átomo numa zona chamada o núcleo do átomo. O núcleo de cada átomo é uma zona muito pequenina, sendo as suas partículas também designadas por nucleões.
Em torno dos núcleos movem-se incessantemente os electrões, formando uma nuvem. Os electrões estão dispersos ao acaso à volta do núcleo, e nunca se sabe exactamente onde está, num dado momento, os electrões.
O número de protões no núcleo representa o número atómico do elemento. A identidade de um núcleo atómico é, assim, definida pelo número de protões nele existentes.
Um protão tem carga eléctrica positiva e um electrão igual carga negativa. Num átomo neutro, o número de protões e electrões é igual; o número de neutrões , que não tem carga eléctrica, pode variar.
Os neutrões possuem uma massa ligeiramente superior à dos protões. Os neutrões são os responsáveis pelo resto da massa do núcleo; exerce uma acção de manutenção do núcleo intacto, adicionando aparentemente forças atractivas que predominam sobre as repulsões eléctricas entre os protões.
Por sua vez os electrões tem a particularidade de serem partículas carregadas negativamente. Movem-se a altas velocidades em torno do núcleo e não descrevem trajectórias definidas, havendo um número suficiente para tornar o átomo, como um todo, electricamente neutro.
Uma vez que o núcleo tem carga positiva, atrai electrões. Se um núcleo atrai um número de electrões exactamente igual à carga nuclear forma-se um átomo electricamente neutro.
Uma vez que uma carga positiva atrai uma carga negativa, é difícil retirar um electrão dos núcleos positivos. Alguns átomos neutros podem ganhar electrões, formando iões negativos.
Também os electrões ora se encontram mais próximos do núcleo, ora mais afastados. Sabemos apenas que, em cada instante, os electrões estão algures num ponto de uma zona do espaço à volta do núcleo. A zona do espaço em torno do núcleo onde é provável encontrar electrões é designado nuvem electrónica.
As zonas por onde o electrão passa mais vezes terá uma maior densidade de pontos, o que é sinónimo de dizer que a probabilidade do electrão lá passar, num dado instante, é maior. As zonas por onde este passa menos vezes, são as zonas que apresentam uma densidade de pontos menor. Esses pontos formam uma "nuvem" em torno do núcleo que não tem fronteira, uma vez que não há região demarcado para o movimento do electrão.
Os átomos não tem todos as mesmas dimensões. Se os considerarmos como pequenas esferas, podemos comparar o seu tamanho através dos respectivos raios atómicos.
|
Átomo de hidrogénio |
Átomo de alumínio |
Átomo de césio |
Um átomo contém electrões e protões. Uma vez que a massa está associada a toda a matéria, é natural admitir que os átomos, que formam a matéria, tenham massa. E, uma vez que qualquer amostra de matéria ocupa um certo volume, podemos também admitir que cada átomo tem um volume.
A maior parte da massa do átomo está no núcleo, isto implica que o electrão pesa muito menos do que o protão. Isto significa que a maior parte da massa do átomo deve ser fornecida pelo núcleo. A massa do núcleo não é, todavia, determinada apenas pelo número de protões.
Biografia:
"Eu gosto de Química" Pereira, Alda Gomes, Ana Gonçalves,Conceição
9°ano, 1995, lª edição - Texto Editora
"Química" Mendonça, Lucinda Santos, Ramalho,Marta Duarte
9°ano, 1995, lª edição - Texto Editora
Enciclopédia do Conhecimento Ciência e Tecnologia Química, Vol.8
Alexander,W. and Street, Clarf, J.O.E.
Resomnia Editores
"Química - Uma ciência experimental" Pimentel,George C.
4ª edição - Fundação Calouste Gulbenkian
"Química", Chang,Raymond
5ª edição, McGraw - Hill
Raquel Moura e Adélia Matos
(12º Ano - Esc.Sec.Barcelinhos)
"A Física do dia-a-dia"
1 - A figura 1 mostra o desenho da Lua no céu do hemisfério norte. Das fases representadas, quais estão correctas e quais estão erradas?

2 - Com o ponto de apoio em A o sistema reproduzido na figura 2 está em equilíbrio. As três velas foram acesas todas ao mesmo e ardem todas com a mesma velocidade. O sistema permanecerá em equilíbrio depois de as velas terem ardido um bocado?

3 – Suponhamos que a água embate de frente nestes três diques da figura 3, feitos por castores. Qual deles é mais resistente e porquê?

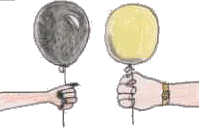
4- Estes dois balões (figura 4) são do mesmo tamanho e estão cheios com a mesma quantidade de hélio. Qual deles sobe mais depressa num dia de sol?
5 – Um homem com uma maromba anda sobre uma corda bamba. Com que é que ele mantém mais facilmente o equilíbrio:
|
a) Com uma maromba comprida ou curta? b) Com uma maromba pesada ou leve? c) Com uma maromba rígida ou flexível? |
 |
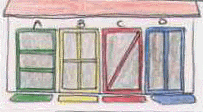
6 – O proprietário de uma casa quer mandar reforçar o portão do jardim. O seu arquitecto fez-lhe as propostas reproduzidas no desenho (figura 6). Qual das quatro dará melhores resultados?
7 – As duas formigas estão muito atarefadas (figura 7). Mas o peso não está igualmente repartido. É obvio que uma das duas formigas suporta um peso maior. Qual delas?

8- Com uma caneta de filtro, pintas um quadrado num balão vazio (figura 8). Que forma assume o quadrado quando encheres o balão?
9 – Imagina que a cozinha de tua casa é muito pequena (figura 9). A temperatura da cozinha pode baixar se se deixar aberta a porta do frigorífico?

Respostas:
1 – As fases representadas nos desenhos A e C estão erradas. Com efeito, para o Sol iluminar a Lua dando-lhe o aspecto que apresenta nestas duas ilustrações, teria de estar também acima do horizonte, isto é seria dia.
Além disso, no desenho A, pode ver-se uma estrela a brilhar através da Lua, o que é impossível.
2 – Sim. O sistema permanece em equilíbrio depois de as velas terem ardido durante um bocado. Se o sistema está em equilíbrio, significa que a soma dos momentos das velas à esquerda de A é igual ao momento da vela à direita: estas anulam-se mutuamente.
Se todas as velas arderem e ficarem reduzidas a metade, também os seus momentos em relação ao ponto A ficarão reduzidos a metade e o sistema continua em equilíbrio.
3 – O mais resistente é o dique C. Tal como no arco de uma ponte, a força é transmitida para os pontos de apoio, que aqui se situam noas margens. Isto confere grande resistência ao dique.
Os outros diques quebrar-se-iam pelo meio logo que a corrente se tornasse mais forte porque os pontos de apoio não conferem qualquer resistência adicional.
4- O balão preto sobe mais depressa porque o Sol ao aquecer o hélio contido nos balões, vai fazer com que estes se dilatem.
As cores escuras absorvem mais calor e, por isso, o latão preto dilatar-se-á mais do que o amarelo.
Segundo o princípio de Arquimedes "qualquer corpo mergulhado num fluido sofre da parte deste uma impulsão vertical, de baixo para cima, igual ao peso do volume do fluido deslocado".
O balão preto, como desloca um volume maior de fluido sofre uma impulsão maior e sobe mais depressa.
5 – A maromba é comprida, pesada e flexível, pendendo para baixo nas extremidades porque, assim, reage com menor brusquidão e absorve melhor os movimentos feitos pelo equilibrista.
Além disso, pendendo nas extremidades, baixa o centro de gravidade do sistema e melhora grandemente o seu equilíbrio.
6- A proposta C é a que resulta numa estrutura mais resistente pois, divide a estrutura em dois triângulos que são absolutamente rígidos.
7- A formiga da frente suporta um peso maior pois o ponto de equilíbrio do lápis é o centro . se uma formiga o transportasse sozinha teria de colocar exactamente a meio. Sendo duas, a que está mais perto do meio suporta um peso maior.
8- Não. O frigorífico não arrefece o ar; apenas retira o calor dos alimentos que contém no seu interior e condu-lo para o exterior. Assim, se a porta ficar aberta, a temperatura do frigorífico ficará igual à do exterior e não o contrário.
Em rigor, a temperatura poderá aumentar devido ao calor do motor e do compressor.
Bibliografia:
Selecções do Reader's Digest, O livro da Juventude,
Lisboa, 1983
Luciana Esteves
(12º Ano - Esc.Sec.Barcelinhos)
|
|
A Química é uma ciência muito útil nos mais variados domínios da actividade humana. A investigação em química leva à produção de materiais novos, alguns bastante complexos, com tecnologias cada vez mais sofisticadas. Esses materiais resultam da transformação de substâncias já existentes, e são a resposta da Química às necessidades ecológicas, de saúde, alimentares, económicas, etc.
Assim, na Saúde, a Química permite a produção de medicamentos ou de outras substâncias com interesse médico, colabora na estudo dos efeitos no organismo dos produtos farmacêuticos (por exemplo, o resultado da utilização prolongada de ligas metálicas em medicina dentária), possibilita a realização de análises clínicas, investiga o efeito das aditivos alimentares.
Na Indústria, a Química contribui para o fabrico e melhoria de produtos alimentares, farmacêuticos, perfumes, cosméticos, plásticos, papel, materiais de construção, entre outros. Sem a Química não conheceríamos as técnicas de fabrico mais adequadas de todos esses produtos.
Na Agricultura e pescas, a Química proporciona a produção de rações para animais, adubos, pesticidas, herbicidas, fungicidas, etc.
Nos Serviços públicos, a Química fornece técnicas fundamentais para a criminologia (é usada nos laboratórios da Polícia Judiciária para descobrir criminosos), para a fiscalização económica (a inspecção das actividades económicas controla a qualidade dos alimentos vendidos nas lojas), para a segurança rodoviária (por exemplo, o teste de alcoolémia efectuado pela polícia de trânsito destina-se a medir a quantidade de álcool no sangue) e para a saúde pública (por exemplo, a verificação do estado da água das praias e das piscinas).
No Domínio do ambiente, a Química estuda a qualidade do ar que respiramos, desenvolve técnicas de despoluição das fábricas, permite analisar a qualidade das águas naturais, etc.
Na Electrónica, a Química cria novos materiais com resistências mais baixas e, por conseguinte, sem perdas de energia por aquecimento.
Na Medicina, porque a saúde não tem preço, muitos cientistas, por todo o mundo, aplicam os seus conhecimentos na procura de: métodos de análise e de diagnóstico cada vez mais eficazes na luta contra a doença, técnicas terapêuticas mais simples e adequadas.
Na Ecologia, estudando o meio ambiente e combatendo a poluição cada vez maior, resultante da sociedade de consumo em que vivemos, propondo soluções que levem a uma Terra mais saudável.
Na Bioquímica, estudando os seres vivos e tentando descobrir como funcionam os seus órgãos, os seus tecidos, as suas moléculas biológicas, desde as mais simples às mais complexas. A investigação neste campo tem dado passos largos, sendo um complemento valioso da medicina, na luta contra as doenças.
Na Agronomia, onde a análise e o tratamento dos solos, aliados à criação de melhores adubos, permitem alimentos cada vez mais sãos.
Infelizmente, nem sempre a Química tem sido utilizada para benefício da Humanidade. Contribui, por exemplo, para produzir armas químicas. Na primeira Guerra Mundial (1914-1918), foram utilizadas armas deste tipo, que afectaram o sistema nervoso. Estas armas estão actualmente proibidas por acordo internacional. Os explosivos produzidos com a ajuda da Química conferem um poder mortífero a quem os utiliza e esses, infelizmente, continuam a ser utilizados nos mais variados conflitos humanos.
Para além desta variedade de contributos, os químicos colaboram com outros cientistas e técnicos, particularmente físicos, biólogos, geólogos e engenheiros das mais diversas especialidades.
Bibliografia
-Fiolhais, Carlos, Valadares, Jorge Silva, Luís
Teodoro, Víctor Duarte
-Química, 8º Ano -
6ª edição, 1996 Didáctica Editora
Mendonça, Lucinda Santos, Ramalho, Marta Duarte
-Química, 8º Ano - 2ª edição, 1995 Texto Editora
Flora Fernandes
(12º Ano - Esc.Sec.Barcelinhos)
No centro da terra, no peixe que nada, na salsa que cresce, na lâmpada que te ilumina, o metal está em toda a parte!
Procura, à tua volta, todos os objectos de metal: lâmina de aço da faca, papel de alumínio, fechaduras das portas, tesouras...
Como reconhecer um metal?
Primeiro pelo seu brilho.
Além disso não consegues ver através dele: o metal é opaco. Se lhe tocas, dá uma sensação de frio, no entanto é bom condutor de calor.
Só há um metal que não é sólido: o mercúrio do termómetro.
Ainda que não os vejas, encontras nos teus alimentos
o ferro que te fortalece, o fósforo necessário à
tua memória, o cálcio para os teus ossos.
Na natureza, onde se encontra o metal?
A maior parte das vezes, está bem escondido! Encontra-se associado a outros materiais nas rochas denominadas minérios. Foi preciso muito tempo para descobrir os metais que nele se encontravam!
Os homens primitivos começaram por utilizar o metal como tinta: esmagando minério de ferro, vermelho e minério de cobre, verde, obtinham cores muito belas para decorar as suas grutas.
Os primeiros metais que trabalharam foram o cobre e o ouro, porque estes se encontram muitas vezes puros na natureza sem que estejam escondidos num minério. Por isso chamam-se metais nativos.
Quando descobrirão o fogo, os homens fizeram outra descoberta importante: o metal fundia com o calor!
Isto permite-lhes extrair os metais dos minérios: ao aquecê-los, as substâncias que envolvem o metal queimam-se, libertando-o .
Há quatro mil anos, os homens tiveram a ideia de misturar, no mesmo forno, dois metais: o cobre e o estanho, um metal cinzento e mole. Fundidos juntos, deram origem ao bronze muito mais resistente e mais duro que cada um deles! Esta mistura de dois metais chama-se uma liga: aumenta as qualidades e a resistência dos dois componentes.
Se o ferro é o metal mais corrente, o ouro é o rei dos metais! É muito raro: numa tonelada de terra, há em média 35Kg de ferro e um centésimo de grama de ouro.
De que são feitas as moedas?
Duma liga que contém principalmente cobre e níquel, um metal prateado, muito resistente.
Os metais encontram-se sobretudo debaixo da terra, em minas.
As primeiras minas eram a céu aberto. Depois, com as necessidades de metal aumentavam, foi preciso procurá-lo cada vez mais longe cavando galerias subterrâneas. Actualmente, a mina mais profunda encontra-se a três mil metros de profundidade, na África do Sul.
Nos últimos dois séculos foram descobertos novos metais:
O zinco, o níquel, o titânio, o urânio ,etc. O alumínio, presentemente o metal mais usado a seguir ao ferro e o mais abundante na terra, foi há pouco mais de cem ano.
O que é o aço?
É ferro com um pouco de carbono. Esta liga é dura e sólida. A idade do aço começou no século XIX. Observa á tua volta os objectos de aço: carroçarias de automóvel, postes, tubos, botões, comboios ... .
Juntando-lhe certos metais em pequenas quantidades podemos conferir-lhe várias propriedades. O aço inoxidável contém cromo e níquel, que o impedem de enferrujar.
Presentemente, pode medir-se a riqueza de um país pelo seu consumo de aço.
Antes de se transformar num objecto, o metal tem muitas etapas a percorrer.
Extraído do seu minério, refinado, isto é purificado o mais possível, misturado com outros metais para formar uma liga... pode enfim ser moldado, como as hélices de barcos.
Ou esmagado ou estirado em laminadores para se obterem as vigas, os carris, a chapa metálica. Ou então com a ajuda de pilões que lhe dão a forma. Ou ainda metido em prensas, como acontece com as carroçarias dos carros.
Graças aos metais, os homens podem construir audaciosos arranha-céus.
Mas é preciso ter em conta as reacções
dos metais à temperatura: quando está frio, as sete
mil toneladas de aço da Torre Eiffel diminuem dez centímetros!
É também necessário protegê-los: a
água e o sal fazem enferrujar o ferro e o aço. Por
isso são pintados, ou recobertos com outros metais que
não se deterioram, com o cromo.
Alguns metais têm aplicações especiais: o
cobalto é usado no tratamento de doenças.
Otília Ferreira
(12º Ano - Esc.Sec.Barcelinhos)
*O vestuário dos bombeiros é feito da fibra aramada.
Este material é forte, tem boas propriedades isoladoras,
oferecendo protecção contra as chamas, calor e água.
*O chumbo (Pb), um metal maleável e pesado é utilizado
para chumbar as botas dos mergulhadores.
*Sabias que 10% do petróleo extraído é para
a indústria farmacêutica e indústria de corantes.
*O diamante, sendo uma das substâncias naturais com bastante
dureza e comm elevado valor precioso, é aplicado essencialmente
na indústria e não como pedra decorativa.
Para (des)enganar!!
*O ouro utilizado nas jóias tem normalmente uma certa percentagem de cobre ou de outro metal, isto porque o ouro é demasiado mole. Assim, sendo uma jóia dita de ouro, contém somente 75% de ouro.
*A fruta oxida-se facilmente, por exposição ao ar, devido às enzimas libertadas das células. Para evitar esse fenómeno, nada melhor do que sumo de limão que impede que as enzimas actuem.

*Nas estradas com neve, muitas vezes, adiciona-se sal para esta derreter mais depressa, evitando a formação de gelo.
Para fazer crescer os bolos é necessário acrescentar fermento à farinha (a menos que a farinha já traga o fermento misturado). O fermento contém bicarbonato de sódio. Este reagente, quando aquecido, produz o gás dióxido de carbono. Este gás ao tentar escapar-se da massa, fá-la crescer tornando o bolo fofo.

Peixes e o PH
* Os peixes europeus da água doce, segundo o relatório
da FAO, suportam PH compreendido entre 5 a 9.
De modo geral, os peixes não substituem a PH<5 e todos
morrem a PH>10.
Para terminar:
Casamento Feliz; Mas salgado

Dica Interssante
*Quando aparecem manchas em gravuras antigas, estas podem ser retiradas através de uma solução muito diluída de água oxigenada colocada sobre as manchas.
O mais doce na cozinha
Experimentar fazer para sobremesa um pudim de clara.
Aqui vão algumas dicas:
- 6 claras
- 7 colheres (de sopa) de açucar. Icing sugar
- sumo de limão
- morango frescos
Batem-se as claras em castelo.
Que se passa quando batemos as claras em
castelo?
Ao bater as claras introduzimos bolas de ar.
Durante a cozedura, as bolhas de ar dilatam-se e o pudim cresce.
As claras não devem ser batidas durante demasiado tempo,
pois tornam-se rígidas, não permitindo que se dilate
com o calor fazendo com que as bolhas de ar rebentem.
As claras não devem ser batidas acabadas de sair do frigorifico
pois são muito viscosas o que torna difícil a introdução
de bolhas de ar.
Antes de bater as claras em castelo adicione o sumo de limão.
Este, sendo um ácido, dissocia-se em iões positivos
e negativos que tendem a neutralizar cargas na cadeia de proteínas,
permitindo assim um melhor desenrolar das mesmas.
Adicione de seguida o açucar pouco a pouco — é
aconselhável icing sugar pois este dissolve-se mais rapidamente
no filme de água que envolve as bolhas de ar.
Unta-se a forma lisa com açúcar queimado, enche-se
com a massa de claras e põe-se a cozer em banho-maria .
Perguntar???
Antes de arrefecer, volta-se a forma para um prato côncavo;
não se retira sem estar completamente frio, para o pudim
não se estragar. Pode acompanhar-se com creme de pasteleiro
e servir com morangos frescos em redor.
Para refrescar a boca, ananás é óptimo, sendo
este um bom digestivo, pois contém uma enzima que, ao actuar
sobre as proteínas, facilita a digestão.
Bibliografia:
- Andrade Teixeira, M.Emilia; Cunha Martins, M Armanda- Nova Química
8º ano –Areal editores
- Maciel, Noémia; Miranda, Ana- Eu e a Química 9º
ano –porto editora.
Clara Magalhães e Sara Vilas Boas
(12ºano- Esc.Sec.Barcelinhos)