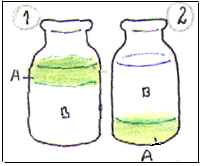
Água ou Álcool ?
Duas garrafas idênticas: uma tem água pura e a outra tem álcool canforado. Como saber qual das garrafas tem o álcool ?
| Pois basta deitar um pouco de azeite em qualquer delas: se ela contiver água, o azeite ficará em cima (A\1); se contiver álcool, o azeite irá para o fundo (A\2). |  |
As cores variáveis
| Desenhou-se uma paisagem e impregnou-se parte dela com uma mistura de 100 partes de água, 1 parte de gelatina e uma parte de cloreto de cobalto ou de cobre. A humidade ambiente produz efeitos sobre a cor desta mistura: se o ar ambiente estiver seco, os sais de cobalto conservar-se-ão azuis; mas, havendo mais humidade na atmosfera, tomarão uma cor rosada. |  |
Um higroscópio caseiro
| Descobriu-se que o sal de cozinha, não refinado, e o mais simples dos higroscópios, visto que, devido a algumas das impurezas que contém absorve a água do ambiente. E por isso que, nos lugares secos, o sal passa bem pelos buraquinhos do saleiro e, nos lugares húmidos, não. |
 |
O canhão de vidro
| Encheu-se uma garrafa com soda e sumo de limão e colocou-se uma rolha de cortiça. Assim que se agitar a garrafa, a rolha salta, impulsionada pelo anidrido carbónico que fez aumentar a pressão no interior da garrafa. |  |
A água, um bem inestimável
Talvez não saibas que em Maio de 1992, na praça publica de uma pequena povoação, o ministro chileno da agricultura abriu solenemente uma torneira de água...do nevoeiro!
A povoação (Chungungo) situa-se numa das regiões mais áridas da terra; a água era trazida de mais de 50 km, em camiões-cisterna. Hoje, a água é obtida nas montanhas da proximidade, pela passagem do nevoeiro através de grandes "colectores" (espécie de redes de polipropileno) onde a água se vai depositando e escorrendo para um depósito, sendo daí transportada para a povoação através de um pipeline.
Esta água é bastante boa para beber, quase não necessitando de cloro.
As cores e o ph
 |
As cores das hortênsias dependem do ph dos terrenos. Um efeito interessante da influência da acidez do solo observa-se nas hortênsias ou hidrânges: crê-se que, se o terreno e neutro ou alcalino, as suas flores se apresentam brancas ou roseas, e se o solo é ácido (ou se acidificou com (NH4)2SO4), as suas flores apresentam cor azul. |
Prata nos pára-brisas
| Talvez não saibas que os pára-brisas de muitos modelos de automóveis tem na superfície uma finíssima e invisível camada de prata por onde circula uma corrente eléctrica, libertando calor suficiente para fundir o gelo e a neve que sobre eles se vão depositando durante a viagem. |  |
Gelo que não flutua na água...
Certamente que só conheces o gelo do teu frigorífico ou da neve que caiu na tua terra o Inverno passado... Esse é o chamado "gelo I", que tem a massa volúmica de 0,917g/cm3 (1 atm, 0ºc) e o volume molar de 19,65 cm3/mol.
Existem outras formas de gelo, obtidas a maiores pressões e diferentes temperaturas; por exemplo, o gelo IV, a 300 K e a altas pressões, apresenta massas volúmicas bastante maiores, não flutuando na água.
O arsénio de Napoleão
Napoleão Bonaparte morreu em Santa Helena em 21 de Maio de 1821, com 51 anos. A sua autópsia revelou que a morte foi devida a um cancro no estômago.
Em 1961, por análise de "activação neutrónica" de alguns dos seus cabelos, revelou-se a presença de arsénio, tendo sugerido então a teoria de que teria sido envenenado.
Analises posteriores mostraram que a quantidade de arsénio encontrada não seria suficiente para provocar o envenenamento e, recentemente, foi possível saber qual a fonte desse arsénio: as rosetas verdes do papel de parede do seu quarto!
Os compostos de arsénio usado nessa época como corantes litográficos dos papéis de parede (verde de sheele e verde de Paris), na presença de humidade e de bolor, dariam origem a formação de compostos voláteis, como trimetilarsenio, (CH3)3As, que se desprenderiam pela atmosfera do quarto e seriam inspirados pelas pessoas.
As rosetas verdes do papel do quarto de Napoleão continham cerca de 0,3 g de arsénio/m2, tendo-se verificado que isto não libertaria para a atmosfera arsénio suficiente para provocar a morte de um ser humano.
Com arsénio, sim... mas vivo.
Chás e tisanas...
O chá é uma das mais famosas e antigas bebidas, tanto no Oriente como no Ocidente. Pode ser chá preto ou chá verde; o preto obtêm-sepor fermentação do chá verde, isto e, por secagem a 93º C durante algumas horas.
O chá é rico em ião floreto (chá verde contém duas vezes mais que o chá preto), bastando uma simples chávena para fornecer o floreto necessário a uma dentição saudável. Contem cafeína (40mg/chavena), embora em menos de metade da quantidade existente no café.
Os polifenois (taninos), mais abundantes no chá verde, dão-lhe um sabor adistringente. Estes polifenóis, que actuam como anti-oxidante, protegem o organismo contra os radicais livres de oxigénio, havendo alguns indícios de que animais a que foram dadas doses repetidas de chá verde (mais ricos em polifenóis) tem menos tendência a desenvolver tumores e cancros de pele.
A segurança dos miraculosos chás de ervas (tisanas), de um modo geral, não tem sido estudada e algumas tisanas tradicionais são mesmo perigosas para a saúde (caso dos chás de consolda e de sassafras, proibidos em muitos países civilizados).
Bibliografia:
Correia, Carlos e outros, Química 10º Ano, Porto Editora
Vários, "O Rui faz descobertas da Química"
Daniel Silva
(12º Ano - Esc.Sec.Barcelinhos)
Alguns porquês do nosso quotidiano
POR QUE SE FORMA O ARCO-ÍRIS?
Quando o sol brilha e ao mesmo tempo chove, a luz do sol pode
decompor-se nas sete principais cores que a forma ao atravessar
as gotas de água da chuva. É o arco-íris. Assim, sem sol e a chuva
juntos não pode haver arco-íris.
A cor branca é formada por uma mistura de cores que podem ser
decompostas com o auxílio de certos prismas transparentes - de
cristal, por exemplo - formando uma imagem conhecida pelos cientistas
como "espectro". O espectro é uma faixa de sete listras principais
de core: vermelho, alaranjado, amarelado, verde, azul, anilado,
e violeta. O arco-íris é o espectro formado pela luz solar ao
atravessar as gotas da chuva, que funcionam então como um primas
de cristal .
POR QUE SE TRANSFORMA ÁGUA EM GELO?
O calor faz derreter a manteiga mas o frio endurece-a. O frio também endurece a água que se transforma em gelo. O gelo é água solidificada. Quando aquecido começa a derreter-se, transformando-se novamente em água.
- A matéria, sob todas as formas - sólida, líquida ou gasosa - é formada por moléculas em movimento perpétuo, mais intenso nos gases que nos líquidos e mais nos líquidos que nos sólidos. A uma temperatura suficientemente baixa e particular a cada corpo, verifica-se a passagem do estado líquido ao estado sólido, sendo a zero graus que a água pura muda de estado e se formam os cristais do gelo.
POR QUE SAI VAPOR QUANDO A ÁGUA FERVE?
O vapor é uma pequena nuvem de gotas de água. Ao sair da caçarola o vapor de água arrefece em contacto com o ar e torna-se semelhante a uma leve neblina.
- Quando se aquece um corpo, água, por exemplo, a agitação das moléculas que o compõem aumenta. Essas tendem a romper as forças que as ligam entre si e a distanciar-se umas das outras, pelo que, do estado líquido, a água passa ao estado de vapor. Não é fumo que sobe, empurrando o ar, mas vapor de água, que condensa em finíssimas gotículas em contacto com o ar frio.
POR QUE É PICANTE A ÁGUA MINERAL?
Existem águas minerais que não picam. As que picam contêm gás, que forma as pequenas bolhas que vemos subir à superfície da água posta num copo. Essas pequeninas bolhas picam a língua, borbulham e salpicam o nariz de quem bebe!
- As águas minerais provêm de fontes termais, alimentares por águas aquecidas nas profundezas da terra e que surgem à superfície do solo depois de no seu percurso através das rochas terem dissolvido sais minerais, mais ou menos picantes conforme a quantidade de gás carbónico que contêm em dissolução .
POR QUE FLUTUAM OS CUBOS DE GELO NUM LÍQUIDO?
Da mesma maneira que as rolhas de cortiça ou as esponjas de plástico, o gelo flutua na água porque é mais leve do ela. Os icebergs são autênticas ilhas de gelo que flutuam na água do mar.
- A água solidificada a zero graus, aumentando de volume e transformando-se em gelo. Assim, o gelo é mais leve que a água, flutuando quando nela colocado. E também flutua nos refrigerantes e noutros líquidos compostos principalmente de água.
POR QUE SE DERRETE O AÇÚCAR NA ÁGUA?
O açúcar derrete-se quando aquecido. Não se derrete posto num copo de água, mas dissolve-se . Por isso se diz que é solúvel. Parece desaparecer na água mas continua lá e basta beber essa água para se perceber que ela ficou açucarada.
- O açúcar não se derrete na água, pois só se derrete sob a acção de calor. É solúvel na água ,isto é, as moléculas encontram-se em estado livre entre as moléculas de água e o todo é perfeitamente estável dentro de determinados limites de concentração.
POR QUE CAEM AS PEDRAS NO FUNDO DA ÁGUA?
Porque são pesadas para o seu tamanho, demasiado pesadas para que a água possa sustê-las. Uma rolha do mesmo tamanho pesa muito menos e é sustida pela água de maneira a flutuar.
- Colocada na água, uma pedra é submetida a uma dupla força: à acção da gravidade, que lhe dá o seu peso e tende a fazê-la cair, ao impulso da água, que se opõe à acção da gravidade e tende a fazê-la subir. Se for mais densa que a água, a pedra irá para o fundo. Se for menor densa, como a pedra-pomes, flutuará .
POR QUE SE VÊ NUMA BOLA DE SABÃO TODAS AS CORES?
A luz do sol é uma mistura de várias cores. A bola de sabão como um prisma tem a propriedade de separar essas cores e de as reflectir, sendo isso que torna as bolas de sabão tão bonitas quando estão no ar, assemelhando-se a pequenos arco-íris.
- Quando passa de um meio transparente para outro, a luz dispersa-se, isto é, as diversas radiações que a compõem são refractadas segundo um índice que varia em cada radiação. É assim que a luz do sol, ao atravessar a balão, é decomposta, vendo-se então todas as cores do espectro, do vermelho ao roxo.
POR QUE FAZ O ÉTER FRIO NA MÃO?
Quando molhamos as costas da mão, sentimos a pele refrescar-se e, quando sopramos a mão molhada, a sensação de frescura aumenta. A evaporação da água produz frio. Como se evapora mais depressa que a água, o éter produz mais frescura que ela.
- O éter é mais volátil, vaporizando-se rapidamente no ar, à temperatura do local onde está . Essa mudança de estado efectua-se tomando calor do meio ambiente. Quando se esfrega a pele da mão com éter, o líquido evapora-se, tirando o calor da pele, cuja a temperatura baixa tanto mais quanto mais rápida for a vaporização. Da mesma maneira, a evaporação do suor do corpo produz frio, que pode ser nocivo à saúde.
POR QUE FAZEM AS PEDRAS CÍRCULOS NA ÁGUA?
Ao cair, a pedra bate na água num determinado ponto da superfície.
O choque forma ondas, que se espalham em todas as direcções a
partir desse ponto, desenhando círculos como os de um compasso.
Os círculos aumentam e acabam por desaparecer.
- Ao bater na água, a pedra transmite ao ponto da superfície em
que mergulha uma parte da energia do seu movimento. Esse ponto,
por sua vez transmite, em igual quantidade, a energia recebida
aos pontos vizinhos, por meio de vibrações, originando as ondulações
que vemos. A energia fornecida pelo choque da pedra espalha-se
assim em concêntricas, de circunferências cada vez maiores.
POR QUE HÁ ECO?
Como os espelhos reflecte mas imagens fazendo retroceder a luz ,as montanhas e as paredes devolvem os sons. A uma distância considerável, diante de uma fileira de árvores, de uma montanha, ou de uma parede, pode-se ouvir o som de um grito lançado alguns segundos antes: é o eco.
- Quando uma onda sonora encontra um muro ou uma parede rochosa, ela reflecte-se, voltando à sua origem. Assim nasce o eco, particularmente límpido se o som emitido for breve e se as ondas sonoras atingirem , mais ou menos normalmente a superfície reflectora. As impressões sonoras persistem no ouvido durante um décimo de segundo. Só há eco quando a distância percorrida pelo som até ao obstáculo é superior a dezassete metros, sendo a velocidade do som no ar de trezentos e quarenta metros por segundo.
POR QUE NOS SENTIMOS MAIS PESADOS QUANDO SAÍMOS DA ÁGUA?
Porque dentro da água somos sustidos, erguidos, como se algo vindo do fundo nos empurrasse para cima. Como, ao sairmos da água, já não somos sustidos, temos a impressão de estar mais pesados. Um corpo mergulhado na água desloca um volume de líquido igual ao seu próprio volume. Esse mesmo corpo, em terra, é atraído pela gravidade. Mergulhado na água, é impulsionado para cima por uma força cuja intensidade é igual ao peso do líquido deslocado. O peso do corpo é, pois, diminuído, sentindo-nos então mais leves na água que em terra - princípio de Arquimedes.
POR QUE DÃO VERDE O AZUL E O AMARELO MISTURADOS?
Todas as cores provêm da mistura de três cores fundamentais: o azul , o amarelo e o vermelho. O azul e o amarelo dão verde; o vermelho e o azul dão roxo.
- Os pigmentos contidos na tinta azul absorvem as radiações luminosas,
excepto as radiações azuis. Os da tinta amarela absorvem as radiações
da luz, excepto as amarelas. Quando se misturam esses dois corpos,
as radiações verdes não são absorvidas. Note-se que quando se
mistura uma radiação vermelha e uma verde do espectro da luz,
e não dos pigmentos, obtém-se a cor amarela.
BIBLIOGRAFIA:
PORQUÊ? 500 Perguntas 1000 Respostas, Bertrand Editora
James Trefil, 1001 Coisas que todos deviam saber sobre ciência, Círculo de Leitores
Mafalda Duarte
(12º Ano - Esc.Sec.Barcelinhos)
A que se deve os nomes que foram atribuídos aos elementos químicos?
Várias foram as razões à atribuição dessas designações. Por exemplo, o hidrogénio deve o seu nome ao facto de ser o gerador da água. Felizmente, do ponto de vista estético, o equivalente alemão desta palavra (Wasserstoff) foi preterido pelo seu correspondente grego.
Outros elementos devem o seu nome à cor da luz que imitem - césio, por exemplo, significa "azul - celeste". Mais recentemente, os elementos químicos tem recebido nomes em honra de cientistas famosos "einsteinio" e "mendelévio" e de lugares "berquélio", Berkeley, na Califórnia, onde este elemento foi observado pela primeira vez
Como é um átomo?
Os átomos são extremamente pequenos, definindo - se como a partícula mais pequena de um elemento. A palavra "átomo" vem do grego e significado "o que se pode dividir" . Os filósofos gregos pensaram muito sobre este tema e chegaram a esta conclusão digna de respeito, tendo em conta os tempos que corriam, mas hoje em dia sabemos que não é assim.
Apresentam uma certa semelhança com o sistema solar, pois o núcleo fixo está envolvido por uma quantidade relativa de electrões que giram à volta deste. Esse número relativo de electrões são os que determinam a natureza dos elementos, tendo um átomo de hidrogénio um electrão enquanto que um de urânio possui 92. Ainda hoje em dia o homem continua a investigar sobre este mundo extremamente pequeno.
Porque é que quando observamos um pau dentro de água temos a sensação
que ele está partido?
Isso ocorre devido a um fenómeno denominado por refracção o qual se deve a um descrever da velocidade da luz. Portanto quando pomos um pau na água causa esse efeito de estar partido devido a que a luz , que no ar se propaga a uma velocidade de3000.000 Kms/Seg., na água só chega aos 25.000Kms/Seg., O que sucede é que é que quando a luz penetra na água a sua direcção muda bruscamente, devido a este decrescer de velocidade. Ao menos que a luz entre na água através de um vidro totalmente perpendicular à sua superfície, esta desviar-se-à sempre dessa forma tão brusca.
A que se deve o facto das substâncias se apresentarem no estado sólido, liquido ou gasoso.
Isto depende do modo como as suas moléculas se mantêm juntas. Os tipos de ligações químicas que referimos anteriormente aparecem principalmente nos sólidos, onde tendem a fixar os átomos numa estrutura rígida. Se empurrarmos um átomo, a força é transmitida a todos os outros, e todo o sólido se move.
Pelo contrário, num líquido, as moléculas estão próximas umas das outras mas não estão unidas; são como berlindes num saco. Se empurrarmos uma molécula, isso não obriga as outras a moverem-se.
Num gás, as moléculas estão bastante separadas e movem-se como bolas de bilhar sobre uma mesa, colidindo ocasionalmente mas, de um modo geral, interagindo apenas minimamente umas com as outras.
Qual a razão de nem todas as substâncias apresentarem o mesma rigidez?
O facto de uma substância ser dura ou mole, flexível ou rígida, depende do tipo de ligações que a mantém unida. Por exemplo, a madeira é uma substância bastante rígida, porque é feita de longas fibras de celulose unidas pelas ligações de hidrogénio e covalente. Pode-se estar de pé sobre uma rocha e não cair no seu interior, porque a rocha é mantida coesa pelas ligações iónicas, uma das mais fortes forças interatómicas. Pode esmagar-se barro entre os dedos, porque a força entre camadas adjacentes de moléculas no barro é do tipo de Van der Waals (elo mais fraco da cadeia molecular).
Não importa de que propriedade da substância se trata; pode-se entendê-la em termos do modo como se unem os átomos.
Por que se produz o raio?
Uma nuvem está cheia de gotinhas, que podem estar carregadas positiva ou negativamente. As partículas negativas atraem as positivas. Frequentemente separam-se por um "isolador", uma matéria que impede a fusão: pode ser o ar uma nuvem, gotas de água... Por vezes, a atracção pode ser tão forte que o isolante explode. Então aparece uma zona de descarga : as cargas positivas e negativas encontram-se e produzem corrente eléctrica. Numa nuvem, esta descarga é o relâmpago. Uma corrente eléctrica potente parte da nuvem para a Terra; é o relâmpago que vemos. Esta descarga dá um golpe seco. A velocidade da luz é de 300.000 Kms/Seg.; a velocidade do som de 340 metros/Seg., o que dá um pouco menos de 1300Kms/hora. A luz chega à Terra mais de pressa que o som.
Por que choramos ao cortar cebolas?
 |
Ao cortar uma cebola, as substâncias nutritivas que contêm, possuem uns azeites bastantes voláteis e de carácter muito activo que contêm sulfuras muito irritantes para os nossos olhos. É por isso que as nossas glândulas lacrimais, como acto reflexo de defesa contra a irritação , segregam lágrimas para proteger os olhos. |
Por que existem as cores?
O primeiro Homem a descobrir o espectro luminoso foi Isaac Newton. Fez a luz solar brilhar através de um pedaço de vidro chamado "prisma". A luz que saiu do prisma estava separada em todas as cores do arco íris: vermelho, laranja, amarelo, verde, azul e violeta. Assim Newton descobriu que a luz branca vulgar é constituída por muitas cores juntas.
Quando a luz solar bate na chuva ou no borrifo de uma mangueira de jardim, vemos ás vezes um arco-íris. Os arco-íris são causados pelas gotas de água que actuam como minúsculos prismas. Separam a luz solar em cores. Estas apresentam-se sempre na mesma ordem, do vermelho ao violeta.
Assim as cores não se encontram nos objectos nem em nós, estão na luz branca que é a soma de todas as cores. Por exemplo uma planta verde parece-nos verde porque absorve todas as cores da luz com excepção da verde, que ela reflecte aos nossos olhos.
Outro exemplo seria o caso de projectar uma luz azul na penumbra sobre dois objectos, um vermelho e outro azul. Resulta que o único objecto que poderíamos ver seria o vermelho, pois o azul absorveu toda a luz azul e por isso passará inadvertidamente sempre e quando esta experiência tenha sido bem feita.
O espectro luminoso comporta-se de um modo diferente dos pigmentos coloridos. Todas as cores da luz (1) se combinam para criar a luz branca , mas quando se mistura diferentes pigmentos coloridos (2) tem como resultado o preto.
Qual o gás que utilizámos para encher os balões?
Designa-se por hélio e (é utilizado sob a forma de líquido para manter os supercondutores frios) não é retirado da atmosfera terrestre.
Provém da desintegração radioactiva de núcleos bem no interior da Terra. Estas desintegrações produzem partículas alfa que abrandam, adquirem electrões e formam o hélio, que é então retido em conjunto com o petróleo e o gás natural. Quando se aproveitam reservas de petróleo e gás natural, o hélio é separado e vendido.
Bibliografia:
Enciclopédia Escolar, Everest Editora
A Nova Enciclopédia das Ciências : A Química, Nina Morgan, Circulo de Leitores.
1001 Coisas Que Todos Deviam Saber sobre Ciência, James Trefil, Circulo de Leitores.
Ciência Resposta a Tudo, Círculo de Leitores, edição: 2092
Manuela Andreia F.Gomes
(12º Ano - Esc.Sec.Barcelinhos)
O que são e para que servem os ácidos
Para além das diferenças existentes entre as concentrações de
iões H+ e OH-, as águas diferem no tipo e na concentração de muitos
outros iões positivos e negativos que costumam conter e têm, por
isso, influências diferentes sobre o nosso organismo, podendo
ser usadas...... no tratamento de muitas doenças.
- Uma solução aquosa que tenha mais iões H+ que OH- é ácida.
- Uma solução aquosa que tenha mais iões OH- que H+ é básica.
Os ácidos dissolvidos na água transmitem-lhe sempre um acréscimo
de iões H+ e conferem-lhe um sabor azedo característico. Entretanto,
deve salientar-se que muitas soluções ácidas são altamente tóxicas,
enquanto outras podem ser bebidas e têm um sabor agradável. Por
vezes, adicionamos ácidos às nossas bebidas só para nos deliciarmos
com o seu travo amargo.
É o que acontece na cerveja,...
cujo mosto ferve durante duas horas em conjunto com flores femininas
de lúpulo, que contêm ácidos na sua constituição e lhe dão o seu
amargor típico.As maçãs, os iogurtes adoçados e muitos tipos de
rebuçados são exemplos de produtos alimentares que possuem ácidos
na sua constituição, mas têm o sabor amargo mais ou menos encoberto
por açúcares.
É conveniente que a água de consumo público seja mais ou menos
neutra, e portanto, nos locais em que ela é demasiado ácida......
costumam existir tanques com soluções aquosas de hidróxido de
cálcio [Ca(OH2)] nas estações de tratamento. Estas soluções alcalinas
vão sendo lançadas na canalização em quantidades adequadas, de
modo a elevarem o pH da água para um valor próximo de 7. Adicionando
uma solução alcalina a outra ácida provocamos uma subida do seu
pH e podemos mesmo neutralizá-la, se conseguirmos igualar as concentrações
de iões H+ e OH- na solução global.
As couves e muitas outras culturas só podem prosperar e assimilar
convenientemente os seus nutrientes, se forem cultivados em solos
neutros ou ligeiramente alcalinos. É por isso que os agricultores
que possuem solos muito ácidos costumam espalhar hidróxido de
cálcio em pó para lhes elevarem o valor do seu pH. Esta operação
agrícola chama-se colagem e também pode ser efectuada com óxido
de cálcio (CaO) ou carbonato de cálcio (CaCO3) pulverizados, porque
qualquer deles alcaliniza a terra, depois de reagir com a sua
humidade ou com a água das chuvas. O nível de fertilidade de um
solo agrícola depende de muitos factores, mas um dos mais importantes
é o valor do seu pH.
Para exemplificarmos as inúmeras utilizações dos ácidos e das
bases na indústria podemos referir que o ácido sulfúrico é usado
na preparação de adubos, (....) e em baterias eléctricas de muitos
tipos...enquanto o hidróxido de sódio tem um papel fundamental
na fabricação dos sabões.
Os ácidos e as bases estão entre os reagentes mais utilizados
nas indústrias químicas:
- Soluções ácidas, como por exemplo, o vinagre e o sumo de limão,
que possuem um característico sabor azedo e são capazes de corroer
alguns metais.
- Soluções básicas ou alcalinas, como os sais de fruto e a água
com sabão, que têm sabor a lixívia e são untuosas ao tacto.
- Soluções neutras, como a água açucarada e a água com sal, que
não manifestam as propriedades das soluções ácidas nem das básicas.
BIBLOGRAFIA
Cesário Viegas; Físico-Química- 8ºano de escolaridade; Editorial O Livro;
Célia Marisa Faria da Costa
(12º Ano - Esc.Sec.Barcelinhos)
1. Ovos aos pulos: o que é que esperavas?
Será que um ovo pode sofrer uma transformação química se o mergulhar em compostos diferentes?
Precisas de:
2 ovos (crus inteiros com casca), um copo de água e um copo com
vinagre.
O que deves fazer:
Põe um ovo dentro de um copo com água e deixa-o lá ficar durante
24 horas. Coloca o outro ovo dentro do vinagre e deixa-o lá ficar
durante o mesmo tempo.
O que acontece?:
O ovo que ficou dentro da água está na mesma, enquanto que o ovo
que ficou na composto de vinagre parece agora uma bola de borracha
e já não tem casca dura! Se o deixares cais dentro do lava-loiça
de uma altura pequena, ele vai mesmo pular. Agora já sabes onde
é que esta experiência foi buscar o nome.
Por quê?
O ovo sofreu uma transformação química dentro do vinagre. O ácido
acético (vinagre) reagiu com o carbonato de cálcio da casca de
ovo. Essa transformação fez com que a casca amaciasse e desaparecesse,
enquanto o ovo que estava dentro do copo com água não sofreu qualquer
transformação química. Os químicos diriam que a casca do ovo dentro
do vinagre se ìdescalcificouî.
2. Conversa doce
Os nossos corpos são reactores químicos complicados, como prova esta simples experiência.
Precisas de:
Uma bolacha sem sal nem açúcar.
O que deves fazer:
Mastiga a bolacha lentamente durante alguns minutos.
O que acontece:
A bolacha tem um sabor doce.
Por quê?
A saliva contém uma substância chamada enzima. A enzima ìstyalinî
fracciona as moléculas de amido ou outros hidratos de carbono
num açúcar simples chamado maltose. Quando mastigas a bolacha,
o amido que ela contém transforma-se em açúcar e, por isso, ela
tem um sabor doce.
NOTA: os compostos orgânicos chamados hidratos de carbono encontam-se
em alimentos como o açúcar, o pão, as batatas e as bolachas de
água e sal. São constituídos por átomos de carbono, de hidrogénio
e de oxigénio.
3. Espectáculo com gelo
Cubos de gelo agarram-se melhor com sal ou sem sal?
Precisas de:
12 cubos de gelo
1 colher de chá de sal
Papel e lápis
O que deves fazer:
Coloca três cubos de gelo em cima de outros três. Marca-os com
a indicação de ìsem salî. Pega em mais três cubos e salpica-os
com um pouco de sal e põe os três últimos cubos em cima dos cubos
salgados. Marca-os com a indicação de ìcom salî. Espera cerca
de cinco minutos até todos estarem parcialmente derretidos.
O que acontece:
Os cubos de gelo salgados agarram-se melhor do que os que não
têm sal.
Por quê?
As moléculas de água movem-se de um cubo para o outro, agarrando-se
umas ás outras. Os cubos de gelo colam-se e ambos os conjuntos,
mas os cubos com sal colam-se melhor. O sal faz com que o gelo
derreta mais rapidamente; por isso as moléculas movem-se de um
cubo para o outro e agarram-se mais depressa. É por isso que o
sal é usado nas estradas, no Inverno.
BIBLIOGRAFIA
VOESCHING, Louis V., Experiências Simples de Química com Materiais
Disponíveis, Bertrand Editora, 1995.
Noémia Miranda
(12º Ano - Esc.Sec.Barcelinhos)
Vivemos num planeta de água, já que 70% da sua superfície está
coberta por uma preciosa camada de água, na maior parte salgada.
Embora a água seja abundante no nosso planeta, só 3% é, potencialmente
utilizável no consumo humano:
2,997 está sob a forma de gelo e glaciares ou a tão grande profundidade
que se torna inviável, em termos económicos e a curto prazo, a
sua extracção.
Os restantes 0,003 são a parte disponível e pode encontrar-se
sob as formas de humidade do solo; águas subterrâneas; vapor de
água; lagos e rios.
Usando um modelo comparativo, pode afirmar-se que, para uma reserva
total de água na Terra de 100L, a água potável corresponderia
apenas a 0,003L, ou seja, meia colher de chã.
No entanto, a quantidade total de água continuamente recolhida,
purificada e distribuída (ciclo da água) é suficiente para as
necessidades globais, apesar de uma desigual distribuição.
Efectivamente, a água está mal repartida pelo mundo, sendo acentuadas
as diferenças de distribuição bem como as de precipitação anual
média.
O mundo pode, por isso, ser, teoricamente, dividido nem duas
partes:
Os que têm água e os que não têm tornando-se a posse de água num
factor de diferença entre a pobreza e a riqueza e mesmo entre
a vida e a morte.
TRATAMENTO DA ÁGUA:
O ciclo hidrológico recompõe as necessidades da água que são
perdidas por evaporação, por deslizamento e por usos humanos.
Esta recomposição não é pacífica porque à medida que água circula
nos rios e oceanos, solos e atmosfera, vai sendo poluída e contaminada;
1ª Fase- A água dos oceanos, rios e outras águas e de superfícies
evaporam-se, passando a fazer parte da atmosfera. Nem o movimento
do vapor de água vai interactuar com outras substâncias Químicas
(como óxidos de enxofre, de azoto, ...) provenientes de indústrias
e veículos motorizados.
2ª Fase- O vapor de água da atmosfera pode, eventualmente, condensar
(devido ao arrefecimento da mesma), dando origem a precipitação
( chuva, neve).
Eventualmente pode formar compostos químicos com os poluentes
da atmosfera, pode estar na origem as chuvas ácidas, arrastando
assim as partículas que se encontram em suspensão na atmosfera.
3ª Fase- Quando a água cai na terra sob a forma de chuva, neve
ou granizo, ela foi á superfície do solo, chegando, a atingir
as águas de superfície ou penetrando no solo. Este deslizamento
é vulnerável á poluição porque recolhe, químicos tóxicos e desperdícios
de proveniência diversa á medida que flui.
Mas apesar de tanta contaminação e poluição ainda existem aquíferos
e superfície de alta qualidade permitem um consumo sem qualquer
tratamento.
Isto não é, numa situação vulgar, sobretudo em zonas de grande
densidade populacional, industrial ou agrícola.
Estas águas captadas têm de ser sujeitas a vários estádios de
tratamento antes da sua distribuição.
Da mesma forma, as águas residuais tanto de usos domésticos como
da indústria ou agricultura têm de ser tratadas para serem lançadas
novamente na natureza.
TRATAMENTO DA ÁGUA PARA USO DOMÉSTICO:
Como se referiu, múltiplos são os factores que contribuem para
que a água fique "impura" em termos de utilização.
Os métodos e o grau de tratamento a implantar determinados,
tanto pelas análises de águas efectuadas, como os parâmetros exigidos
na água considerada potável.
Em localidades distanciadas dos grandes e médios centros, é frequente
o tratamento das águas serem realizados calmamente através de
tanques sépticos, em que não há ligação rede de abastecimento
pública.
No entanto nos médios e grandes centros populacionais ás estações
de tratamentos de água (E.T.A.), são mais complicadas.
As estações de tratamento de águas, na grande maioria, apenas
envolvem tratamento dos contaminantes mais vulgares e que obrigam
ao uso de:
Filtros;
Leito de areia e gravilha;
Tanques de sedimentação;
Arejadores; sequência de alguns equipamentos
Tanques de cloração; (E.T.A.)
Ao longo dos diferentes tratamentos, realizam-se algumas operações
unitárias, tais como:
Coagulação e floculação;
Sedimentação;
Decantação e filtração;
Cloração;
1ª Fase- Coagulação e floculação
A água depois de ser sujeita a uma filtração para reter as partículas
de maior dimensão, ainda apresenta uma turvação devida, sobretudo,
a partículas coloidais de argila e lama.
Estas partículas, por possuírem cargas electrostáticas do mesmo
sinal, não conseguem se juntar e, consequentemente não se aglomeram
de forma natural em partículas de maiores dimensões.
Para efectivar esta aglomeração é necessário a adição de coagulantes
químicos (por exemplo, sulfato de alumínio) que têm como funções:
a) Neutralizar a carga eléctrica (coagulação)
b) Promover a colisão entre as partículas (floculação)
2ª Fase- sedimentação
Os flóculos formados são agora separados da água, por acção da
gravidade, em tanques (tanques de sedimentação) que permitem que
as partículas mais densas se depositem no fundo.
As lamas (flóculos) não são biodegradáveis e acumulam-se, sem
decomposição, no fundo dos tanques devido á gravidade (sedimentação)
e são retiradas pela parte inferior do tanque.
3ª Fase- filtração
Aproveitando o exemplo da natureza da água em que a água se vai
purificando ao atravessar camadas sólidas arenosas (ou não) desde
zonas de profundidade até á superfície, as estações de tratamento
de águas usam leitos de gravilha e areia para purificar a água.
Este processo de filtração é rápido e envolve duas fases:
a) Filtração da água;
b) Lavagem do leito de areia;
4ª Fase- cloração \ desinfecção
A água, após sofrer filtração, sedimentação e arejamento é desinfectada
em tanques de cloração usando cloro que mata os microorganismos,
principalmente os patogénicos.
O cloro é adicionado em quantidades calculadas previamente, para
que a sua concentração final na água seja a adequada, mantendo,
no entanto, um nível residual de cloro que assegure uma desinfecção
em situações imprevistas de aumento de concentrações bacteriológicas.
Esta acção bacteriológica do cloro é consequência da existência
das espécies HClO e ClO- que são verdadeiros desinfectantes e
constituem o chamado cloro livreî da água.
TRATAMENTO DE ÁGUAS RESIDUAIS (EFLUENTES INDUSTRIAIS E DOMÉSTICOS)
O tratamento de efluentes industriais ou domésticos, é hoje encarado
como uma necessidade urgente e primária, para que se possa reutilizar
a água sem prejuízo da saúde humana e ambiental.
Este tratamento realizado nas Estações de Tratamento de Águas
Residuais (ETAR) que tanto podem utilizar um processo aeróbio
como anaeróbio.
a) COMPOSIÇÃO E RESPECTIVOS TRATAMENTOS DE ÁGUAS RESIDUAIS
As descargas de água numa rede de esgotos são constituídas por:
- Pluviais;
- Residuais domésticas;
- Descargas industriais.
As descargas de pluviais aumentam apenas o volume das águas residuais,
tendo como consequência o problema do seu armazenamento.
Os efluentes domésticos também engrossam o caudal das águas residuais
e, normalmente, só precisam de tratamentos chamados primário e
secundário.
Efluentes industriais acarretam problemas bem diferentes pois
as suas descargas não são uniformes e variam com:
- Tipo e tamanho da indústria;
- A exigência ou não de tratamentos prévios desses efluentes antes
de descarregados na rede pública ou nos cursos de água adjacentes.
Habitualmente, estes efluentes transportam metais tóxicos, materiais
radioactivos, compostos orgânicos não degradáveis (óleos, gorduras...),
cuja destruição não pose ser resolvida nas ETAR, uma vez que estas,
fundamentalmente, tratam da eliminação de sólidos em suspensão
e da carência bioquímica de oxigénio.
Existem três etapas de tratamento dos efluentes:
1-TRATAMENTO PRIMÁRIO
Esta tratamento separa o material sólido grosseiro, o cascalho,
a areia e as partículas finas que sedimentam pela acção da gravidade
e formam as lamas.
São igualmente removidos os materiais insolúveis como óleos e
gorduras, que, permanecendo à superfície, são retirados por processos
mecânicos.
2-TRATAMENTO SECUNDÁRIO
É um conjunto de tratamentos em que se inclui processo biológico
em que se utilizam bactérias aeróbias para remover cerca de 90%
dos materiais biodegradáveis e as carências de oxigénio provocadas
por desperdícios orgânicos e que actuam fundamentalmente por dois
processos:
- As águas residuais passam através de um leito de cascalho e
gravilha coberto com bactérias e protozoários;
- As águas residuais são bombeadas para um tanque com lamas activas
( lamas ricas em bactérias e oxigénio).
Na fase seguinte, a água é transportada para o tanque de sedimentação,
onde a maior parte das partículas em suspensão e microrganismos
são depositados como lamas.
Estas lamas, bem como as provenientes do tratamento primário,
são conduzidas para biodigestores anaeróbios onde é produzido
gás metano que, eventualmente, se utiliza na produção de energia
eléctrica necessária à ETAR.
O material sólido não digerido é aproveitado para a produção de
adubos orgânicos ou lançado nos oceanos ou nos campos.
3-TRATAMENTO TERCIÁRIO
Consiste num conjunto de tratamentos químicos e físicos especializados
na remoção de determinados poluentes que se mantêm na água depois
de ter passado pelos tratamentos anteriores.
O tipo de tratamento utilizado dependente da contaminação que
se pretende remover.
Sem este tratamento, as águas que contêm, por exemplo, excessos
de nitratos e fosfatos, contaminando lagos, rios e oceanos.
No entanto, como é um tratamento extremamente caro tanto na construção
como na operação, raramente se utiliza.
Anates da água ser descarregada após tratamento primário, secundário
ou terciário, tem de sofrer uma desinfecção, através da cloração
a fim de perder a cor e as bactérias /eventualmente, os vírus
) causadores de doenças.
Com a mesma finalidade podem ser usados ozono ou raios UV ( embora
sejam muito mais dispendiosos).
TRATAMENTO DA ÁGUA PARA FINS INDUSTRIAIS
A água usada pelo homem nem sempre é consumida então há uma recuperação
desta, no consumo público, onde 90% da água utilizada, regressa
aos cursos da água; o mesmo acontece ao nível industrial onde
se faz recuperações da ordem dos 98%.
Consoante a utilização, na água têm de se observar determinadas
características, podendo ser considerados três fins principais
(na industria):
1- Produção de vapor para o qual são indesejáveis substâncias
corrosivas, substâncias encrostantes e substâncias espumíferas.
2- Arrefecimento, que no caso de ser por aspersão exterior dos
reactores não requer tratamento especial, mas se for para o arrefecimento
de motores, compressores, permutadores de calor, já requer tratamentos
idênticos aos das águas para aquecimento.
3- Processo que, consoante a natureza e características da água
natural, requer tratamentos diversificados.
BIBLIOGRAFIA:
-Saraiva, E. C.; Técnicas Laboratoriais de Química- Bloco III;
Porto Editora; Portugal,
-Teresa S. Simões, Maria A. Queirós, Maria O. Simões, Técnicas
Laboratoriais de Química- Bloco III; Porto Editora; Portugal
Ricardo Ferreira
(12º Ano - Esc.Sec.Barcelinhos)
A química, uma obra da Humanidade.
 A palavra de um Historiador da Química.
A palavra de um Historiador da Química.
Antes de Lavoisier demorava muito tempo até alguém ser reconhecido
como um químico : uma vida inteira a coleccionar factos, a memorizar
nomes exóticos, a realizar centenas de reacções. Tudo isto para
dominar um assunto e transmiti-lo de forma um tanto esotérica
a alguns escolhidos - denominados "iniciados . Esta imagem do
Experimentador isolado, do homem alheado do seu ambiente e apenas
concentrado num dado objectivo (talvez o da transmutação dos elementos
em ouro),do pregador de uma linguagem esquisita é ainda prevalecente
quando se pensa no químico. Contudo, já há muito que a Ciência,
e em particular a Química, deixou de ser descritiva. O conhecimento
não é apenas cumulativo e a experiência laboratorial não constitui
o único método que permite encontrar soluções para os problemas.
Desde os primeiros tempos, a Humanidade estudou os materiais
que nos rodeiam. Quase sempre, visando o seu aproveitamento, quer
para o bem-estar das populações quer para actividades bélicas.
Algumas vezes, sem aparente finalidade imediata.
O saber sucessivamente acumulado por gerações e gerações de povos
conduziu à produção de muitos materiais que não existem na Natureza,
tais como ligas metálicas, cimentos, medicamentos diversos . Apesar
de todo o imenso esforço na procura do saber a humanidade despendeu
milénios. Foi apenas no sec.XVII, há cerca de 350 anos que se
começou a ter ideia mais precisa dos fenómenos que envolvem a
matéria.
Primeiros Passos
Os primeiros passos foram dados quando Demócrito(468-370 a.C.) defendeu a teoria que a matéria seria constituída por partículas que não se podiam dividir. Chamou-lhes átomos . Pensava que os átomos de substâncias diferentes deveriam ser diferentes: por exemplo os átomos das substâncias que "picam" na língua deveriam ser pontiagudos, e os das substâncias "doces" deveriam ser redondos .
Nota: A palavra átomo vem de um termo grego que significa à letra:
não dividido ou indivisível.
Mas outras teorias surgiram, como por exemplo Empedocles, cerca
de 400 a.C., sugeriu a existência de quatro elementos: Terra,
Ar, Água e Fogo (constituintes básicos da matéria). Também o grande
gigante intelectual do mundo antigo, Aristóteles (384-322 a.C.),
considerou esses elementos como provenientes de uma substância
primária ("Hile") à que lhe atribuiu qualidades ou propriedades
fundamentais.
Estes Quatro elementos, quando misturados em várias proporções,
originavam as diversas substâncias e, inversamente podiam ser
decompostas nos quatro componentes. Cada elemento parecia possuir
uma qualidade comum a outro, o que levava a concluir que ou quatro
elementos eram em principio, inconvertiveis. Por exemplo o fogo
tem qualidades "seco" e "quente" e o ar as qualidades "quente"
e "húmido".
Físico e químico anglo-irlandês, um dos primeiros investigadores
que tentaram imprimir forma científica ao atomismo dos Antigos.
Com a sua obra "The Septical Chimist" enceta uma nova era na Historia
da Química, esboçando, de modo um tanto vago, os conceitos modernos
de átomo. Os seus estudos percorreram campos como a Hidrostática,
ao som, à pressão e à respiração. Foi autor da lei de Boyle-Mariotte.
Boyle verificou experimentalmente que um determinado gás, encerrado
num recipiente fechado, munido de êmbolo, diminui de volume sempre
que aumenta a pressão exercida no êmbolo.
Dos resultados desta experiência Boyle concluiu, que toda a matéria
é composta por pequeníssimas partículas.
Teoria: Lei de Boyle e Mariotte.
Através da experiência atrás demonstrada Boyle e Mariotte concluíram também que, a temperatura constante, o volume de uma dada massa varia inversa da pressão do gás.
Priestley, Joseph (1733-1804)
Nasceu perto de Leeds, Inglaterra, em 13 de Março de 1733. Filho
de um tecelão, ficou órfão aos sete anos; estudou para pastor
presbiteriano, tendo aprendido, Latim, Grego, Hebreu, Francês,
Alemão, Italiano, Árabe e Aramaico. Ao estudar o gás da fermentação
do malte numa fabrica de cerveja em Leeds, verificou tratar-se
de dioxido de carbono e ao faze-lo borbulhar em água pura, obteve
água gaseificada.
Teoria: Solubilidade
Qualquer pessoa sabe que o sal e o açúcar são bastante solúveis
em água, o mesmo se pode dizer do CO2.
A solubilidade é a quantidade máxima de soluto (em moles) que
se pode dissolver num dado solvente para obter um litro de solução
saturada, a uma dada temperatura.
Produto de Solubilidade é uma constante de equilíbrio (que só
depende da temperatura), para uma solução saturada de um composto
pouco solúvel e, portanto, não se altera com a presença de outros
constituintes na solução em equilíbrio com o soluto sólido a que
se refere.
A solubilidade depende da temperatura, como por exemplo as solubilidades
do NaCl a do KNO3 aumentam com o aumento da temperatura, e a do
Na2SO4 diminui com o aumento da temperatura.
Lavoisier, Antoine Laurent (1743-1794)
Antoine Lavoisier (1743-1794), proveniente de uma abastada família
parisiense, nasceu em 26 de Agosto de 1743. A sua condição social
permitiu-lhe uma boa educação, tanto no domínio das leis como
no das ciências. Cedo se dedica à Química, sendo de assinalar
os seus importantes trabalhos sobre a teoria da oxidação (combustão,
decomposição de oxidos, etc.). É considerado O Pai da Química
Moderna. Dos seus estudos nasceu a célebre Lei de Lavoisier, que
se pode considerar a mais importante das leis da Química.
Alem de químico excepcional, notabilizou-se noutros domínios,
nos quais prestou valiosos serviços à França. A sua fama não tinha
fronteiras. A sua ascendência social, bela situação económica,
posição na Academia Francesa e outras posições invejáveis iriam
aguçar o apetite e sede de vingança dos medíocres ... Preso durante
a Revolução Francesa é guilhotinado em 1794. Na opinião dos juizes,"
a República não necessitava de cientistas". Os cientistas sabiam
(e Lagrante dizia-o) que: " um instante bastou para ceifar esta
cabeça, mas nem cem anos chegarão para produzir outra parecida
". Lavoisier, efectuou trabalhos nos quais observou
que uma libra de enxofre origina mais que uma libra de ácido sulfurico.
Dai especulou que o aumento de peso, é devido ao ar que se fixa
durante a combustão e, se combina com os vapores. No ano de 1772
formulou a teoria do Principio do Oxigénio, no qual o oxigénio
vai ser um "gerador de ácidos", ou seja, vai ser o elemento unificador
entre os elementos. Efectuou estudos sobre a respiração dos animais
e sobre as transformações que o ar sofre ao passar pelos pulmões.
Teoria: Lei de Lavoisier
O trabalho de Lavoisier é caracterizado sistematicamente como
quantitativo, já que a balança era um dos instrumentos fundamentais
do seu trabalho. Lavoisier não foi, no entanto, o primeiro a aplicar
métodos quantitativos á Química, já estes haviam sido utilizados
por Boyle e Joseph Black (1728-1799) foram um modelo para Lavoisier,
principalmente a sua ideia da indestrutibilidade da matéria. Desta
ideia Lavoisier formulou a Lei da conservação da massa:"(...)
nada é criado nas operações quer experimentais quer da natureza
e, consequentemente, posso deduzir como axioma que em qualquer
operação existe uma quantidade de matéria igual antes e depois
da operação(...)".
Lavoisier aplicou ideia da conservação da matéria num caso concreto.
Uma destilação prolongada de água permitia a conversão desta em
terra (deposito terroso), uma convicção corroborada pela existência
de um resíduo solido no fundo do recipiente destilador, e que
teoricamente estava de acordo com a antiga ideia dos quatro elementos
de Aristóteles.
Efectuou então outra experiência na qual depois de ter pesado
o recipiente da destilação observou que este pesava menos do que
no inicio. Logo concluiu que o resíduo solido provinha do ataque
da água ao vidro durante os 121 dias de destilação.
Volta, Alessandro (1745-1827)
Físico italiano, nascido em Como. Dedicou grande parte dos seus
estudos à "electricidade", tendo apresentado uma teoria (voltanismo)
com a qual pretendia explicar a electricidade dinâmica como um
fenómeno não especifico da matéria orgânica.
Teoria: Pilha de Volta
Para produzir corrente eléctrica permanente, Volta utilizou
um sistema constituído por uma placa de cobre e uma placa de zinco,
separadas por uma placa de feltro embebido em solução aquosa de
ácido sulfurico. este sistema é denominado por elementos de pilha
de Volta. As duas placas designam-se por pólos ou eléctrodos
do elemento de pilha e a solução por electrólito. Entre as placas
de cobre e zinco, Nestas condições, consegue-se obter uma diferença
de potencial de 0,8 volts.
Para obter uma diferença de potencial maior, Volta associou diferentes
elementos de pilha, "uns em cima dos outros", construindo assim
uma "pilha de elementos".
O funcionamento baseia-se em alterações químicas, isto é, alterações
na constituição dos materiais que constituem o elemento de pilha.
são as alterações químicas que provocam o aparecimento da diferença
de potencial dos pólos do elemento de pilha.
Dalton, John (1766-1844)
Físico e naturalista inglês, descreveu pela primeira vez a perversão do sentido das cores, anomalia de que ele próprio padecia e que mais tarde recebeu o nome de Daltonismo. Enunciou a chamada Lei de Dalton, ou das proporções múltiplas, e deu inicio à teoria atómica moderna; estabeleceu a primeira tabela de pesos atómicos.
Teoria atómica de Dalton.
Em 1808, Dalton publicou um livro no qual apresentava uma teoria
que lhe permitia explicar alguns fenómenos conhecidos nesse tempo,
em particular as reacções químicas. Dalton considerava, tal como
Demócrito que os átomos eram indivisíveis. A partir de experiências
efectuadas com gases Dalton formulou a sua teoria. Afirmou que
a matéria é constituída por partículas muito pequenas, chamadas
átomos, e que estes são indivisíveis e indestrutíveis.
Para Dalton os átomos de um mesmo elemento químico são idênticos
e têm o mesmo peso, mas se são de elementos diferentes têm pesos
diferentes. Quando diferentes elementos se combinam para formar
um composto, a porção mais pequena do composto consta de um número
definido de átomos de cada elemento. Nas reacções químicas, os
átomos não são criados nem destruídos, somente se modifica a sua
distribuição.
Avogadro, Amadeo (1776-1856)
Amadeo Avogadro, conde de Quaregna e Ceretto, nasceu em Turim, na Itália. Estudou direito e, em 1800 iniciou os seus estudos de Matemática e Física. Foi professor no Real Colégio de Vercelli e na Universidade de Turim. Dois anos após a descoberta das leis de Gay-Lussac, publicou um trabalho sobre a interpretação das leis das combinações gasosas e em 1811 formulou a célebre lei: "em volumes iguais de diferentes gases, na mesmas condições de temperatura e pressão, existe o mesmo numero moléculas". Mostrou que a formula da água é H2O e não HO.
Teoria: Principio de Avogadro
Após o trabalho de Dalton surgiram duas correntes sobre a constituição
das substâncias; uns consideravam que as substâncias eram constituídas
por simples átomos, mas outros consideravam que as substâncias
eram constituídas por grupos de átomos - as moléculas. Muitos
Químicos dedicaram-se à determinação do peso atómico .
Avogadro, sugeriu um processo que seria fundamental para a determinação
de pesos atómicos. Segundo ele, "nas mesmas condições de pressão
e temperatura, o numero de moléculas que constitui qualquer é
sempre o mesmo se o volume for igual, ou por outras palavras,
o numero de moléculas é proporcional ao volume de gás". Este
principio permitia comparar o peso de volumes iguais de gases
diferentes. Deste modo era possíveis calcular quantas vezes é
as moléculas de um gás pesavam mais do que as moléculas de outro
gás.
Constante de Avogadro: número de partículas existentes numa mole
de qualquer substância è sempre o mesmo-6,02 x 1023.
Faraday, Michel (1791-1867)
Nasceu em Surrey, Inglaterra, em 22 de Setembro de 1791. Filho
de um ferreiro, começou a trabalhar como distribuidor de jornais
aos treze anos e como aprendiz de encadernador, um ano depois,
o que lhe proporcionou muitas leituras que desenvolveram o seu
interesse pela ciência.
Em 1812 foi contratado por Sir. Humphrrey Davy como assistente
pessoal em 1815, passou a trabalhar em"The Royal Institution of
Great Britain" como preparador e demonstrador de Química. De 1830
a 1851, foi professor de Química na "Royal Military Academy".
Em 1826, iniciou as suas celebres e populares conferências das
sextas-feiras, acompanhadas de espectaculares demonstrações experimentais.
Descobriu compostos químicos novos (benzeno). Descobriu a indução electromagnética, electroquimica, leis de electrolise de soluções aquosas, cátodo, ânodo, ião, electrólito, etc.
Teoria: Cátodo, ânodo, ião.
Cátodo - Eléctrodo de um circuito eléctrico que está, geralmente,
a potencial mais baixo.
Ânodo - eléctrodo positivo de um circuito eléctrico .
Ião - Designação de um átomo ou átomos, que captam ou libertam
um ou mais electrões, ficando com carga eléctrica negativa ou
positiva. Um ião positivo designa-se por catião, e quando negativo
designa-se por anião.
Joule, James Prescott(1818-1889)
Nasceu em 24 de Fevereiro de 1818, em Salford, perto de Manchester,
Inglaterra, foi aluno de John Dalton. Aos 20 anos, começou as
suas próprias pesquisas num laboratório montado por seu pai junto
à sua fabrica de cerveja. Posteriormente, dirigiu os negócios
com grande sucesso, alem de prosseguir um intenso trabalho em
química e física, tendo sido pioneiro no estudo dos efeitos térmicos
da corrente eléctrica (efeito Joule).
A sua sugestão de que a água no fundo das cataratas do Niagára,
que têm 50 metros de altura, devia estar mais quente 0,11 graus
celsius que no topo devido à diminuição da energia potencial,
no inicio foi rejeitada mas veio a ser aceite pelos seus contemporâneos.
Joule realizou cuidadosas medidas de conversão de trabalho em
calor
Teoria: Efeito Joule
As colisões dos electrões de condução com os átomos dos condutores, ao aumentarem a vibração destes, aumentam a temperatura dos condutores, este efeito é denominado de Efeito Joule.
Mendeleiv, Dimitry Ivanotch (1834-1907)
Químico russo, estudou em Sampetesburgo e trabalhou na Alemanha com Kirchoff e Bunsen, na Universidade de Heidelberga, onde se doutorou. Devem-se-lhe valiosos trabalhos no campo da Física e da Química , dos quais se destaca a sua classificação periódica dos elementos.î Tabela Periódicaî.
Teoria: Tabela periódica
Durante o século passado os químicos procuraram uma sistematização
dos elementos para facilitar o seu estudo e a organizarem os conhecimentos.
Quer isto dizer que tentaram organizar ou arrumarî os elementos,
segundo determinados critérios.
Mendeleiev ordenou o elementos segundo a ordem crescente das
suas massas atómicas relativas, dispondo-os numa tabela de acordo
com as propriedades. Este critério conduziu a existência de lugares
vazios na tabela . Mas para Mendeliev cada espaço vazio correspondiam
a elementos que existiam necessariamente. Tabela periódica contém
todos os elementos conhecidos.
Na tabela os elementos estão organizados segundo a ordem crescente
dos números atómicos. Existem colunas verticais, que se designam
por grupos, e por linhas horizontais que se designam por período.
Ostwald, Wilhelm (1883-1932)
Químico alemão nascido em Riga. Foi autor de importantes trabalhos
sobre electrólise e catálise, tendo recebido o Prémio Nobel da
Química em 1909. Em 1887 tomou a direcção da cadeira de Química-Física
em Leipzig, onde atingiu o cargo de director do Instituto de Química-Física.
em 1905 dirigiu um curso na Universidade de Harvard, retirando-se
da actividade científica um ano depois. Foi um dos criadores da
teoria energética.
Teoria: Lei da Velocidade de uma reacção Química.
A velocidade de reacção, é directamente proporcional com a concentração
dos reagentes.
Esta é também influenciada directamente pela temperatura do
sistema da reacção. Também é influenciada pelo estado de divisão
em que os reagentes se encontram, influenciando directamente a
velocidade de reacção. A presença de catalisadores irá influenciar
no sentido
directo a velocidade da reacção
Van der Waals, Johannes Diderik ( 1837- 1923)
Nasceu em Leiden, na Holanda, em 1837, e licenciou-se em Física
na Universidade de Leiden, 1873.
Foi professor de Física na Universidade de Amsterdão desde 1877
a 1907 e, em 1910, obteve o Prémio Nobel da Física como reconhecimento
dos e seus importantes trabalhos sobre as propriedades dos líquidos
e dos gases. Foi o pioneiro no estudo das forças intermoleculares
em sólidos, líquidos e gases. Desenvolveu uma teoria cinética
para os fluidos.
Os trabalhos mais conhecidos de Van der Waals referem-se ás relações
entre pressão, volume e temperatura, expressas numa equação de
gases modificada para a aplicação aos gases reais, em que considera
o volume ocupado pelas moléculas e as forças de atracção intermoleculares
entre as moléculas gasosas ( as Forças de Van de Waals ). O desenvolvimento
dos seus trabalhos proporcionou a realização de estudos posteriores
no domínio dos líquidos e das soluções, como a dissociação de
electrólitos e aspectos termodinâmicos da capilaridade.
Gibbs, Josiah Willard (1839-1903)
Nasceu a 11 de Fevereiro de 1839, em New Haven, Connecticut, Estados
Unidos da América do Norte, e ai estudou e passou a maior parte
da sua vida.
Com 24 anos de idade, apresentou uma tese sobre engrenagens
de rodas dentadas, pela qual obteve o segundo doutoramento (Ph.
D.) em Ciências atribuído nos Estados Unidos. Nos três anos seguintes,
dedicou-se ao estudo de Latim e Matemática e, de 1866 a 1869,
fez estudos de Matemática e Física na Universidade de Berlim,
Heidelberg e Paris.
Após o seu regresso a Yale, retomou a sua actividade de docente
universitário; de 1871 até à sua morte, foi professor de Física
Matemática na Universidade de Yale e dedicou-se à investigação
no domínio da termodinâmica, da análise vectorial, da óptica e
da mecânica estatística.
Gibbs estabeleceu a conexão da Termodinâmica com o Equilíbrio
Químico, para a qual são consideradas fundamentais as suas contribuições,
em especial o notável artigo " On the Equilibrium of Heterogeneous
Substances".
Henri Louis Le Châtelier (1850-1936)
Engenheiro de minas e professor de química em varias escolas francesas.
Dedicou-se ao estudo de reacções relacionadas com a sua arte foi
o autor do Principio de Le Chatelier.
Teoria: Principio de Le Chatelier.
Qualquer sistema que se encontre em equilíbrio químico estável,
quando submetido à influencia de uma causa externa tende a modificar
quer a sua temperatura quer a sua condensação, por completo ou
apenas em algumas partes, pode sofrer tais modificações internas
que resultam numa modificação da temperatura ou da condensação
de sinal contrario ao da causa externa.
Van't Hoff, Jacoubs H. (1852-1911)
Nasceu em Roterdão, na Holanda, e viveu na Alemanha, em França
e na Holanda, tendo estudado em varias escolas superiores e sido
discípulo de KeKulé e de Wurtz. Doutorou-se na Universidade de
Utreque e foi professor na escola superior de Utreque e nas Universidades
de Amsterdão e Berlim. Era considerado pelos seus contemporâneos
o mais notável Químico-Físico.
Foi pioneiro em vários domínios da Química, nomeadamente no estudo
das moléculas no espaço (estereoquímica), do equilíbrio químico,
da cinética química, do equilíbrio em sistemas gasosos, das propriedades
coligativas da soluções.
Fazia parte de um notável grupo de três cientistas contemporâneos
(ele, Arrhenius e Ostwald) que foram os principais responsáveis
pela criação de u novo ramo da Química, que se passou a designar
por "Química-Física".
A sua teoria do carbono tetraédrico foi ridicularizada por um
notável químico seu contemporâneo (H. Kolbe), mas Van't Hoff
encarou a critica com humor e superioridade, pois sabia que em
breve Kolbe se iria arrepender de a ter feito.
A sua personalidade e as importantes contribuições que deu à
Química deram-lhe o Prémio Nobel da Química em 1901, o primeiro
a ser atribuído.
Teoria: Equilíbrio Químico.
Para van't Hoff um equilíbrio químico é aquele no qual o processo
é reversível e dinâmico.
É um processo dinâmico quando as reacções inversas ocorrem a
velocidades iguais.
Sugeriu também que uma reacção atinge o equilíbrio quando as concentrações
dos reagentes e dos produtos se mantêm constantes.
Planck, Max (1858-1947)
Proeminente físico alemão, recebeu o Prémio Nobel da Física de
1918, em reconhecimento dos seus trabalhos sobre a Teoria quântica,
uma teoria tão revolucionária que a comunidade científica a olhou
com enorme cepticismo, parecendo que a Física se voltava de pernas
para o ar... O próprio Planck procurou explicar por meio da Física
clássica os estranhos factos experimentais que o levaram a desenvolver
a teoria, mas nunca o conseguiu (nem ninguém o poderia conseguir
porque, a nível atómico e molecular, a Física clássica não tem
total validade.)
Em 1913, Neils Bohr descrevia assim a essência do trabalho de
Planck: " o ponto essencial da teoria de Planck sobre a radiação
consiste no facto de a energia radiada de um sistema atómica não
ter lugar de um modo contínuo, como supõe a electrodinâmica ordinária
mas, ao contrário, ter lugar por emissões distintas e separadas,
de energia de determinados valores.
Teoria: Teoria Quântica
Os quanta são quantidades de energia que a matéria emite ou absorve
de uma forma descontínua, e não é possível haver transferência
de uma quantidade de energia inferior à do Quantum.
Planck admitiu que, a absorção, propagação e emissão de energia
pelos corpos se faz de um modo descontínuo e elaborou a teoria
dos quanta. A absorção, propagação e a emissão processa-se de
uma forma descontínua por múltiplos inteiros de uma quantidade
mínima de energia, que é representada por q que se designa quantum
de energia.
Ácidos e bases
Foi o químico sueco Svante Arrhenius quem propôs que as propriedades
acidas e básicas eram devidas à presença de certos iões em solução.
Arrhenius foi um dos fundadores da Química-Física moderna. Estudou
na Universidade de Uppsala e escolheu a Física como área científica
principal para o seu doutoramento. Descontente com o seu orientador
Tobias Robert Thalén, abandona em 1881 a Universidade para trabalhar
em Estocolmo com Erik Edlund. Depois de publicar o seu primeiro
artigo científico ( aos vinte e dois anos!), faz as primeiras
meditações da condutividade dos electrólitos no Inverno de 1882;
entusiasma-se por este assunto e apresenta uma dissertação de
doutoramento em 1884 em que discutia a teoria da dissociação electrólica
e nomeadamente a relação entre a condutividade e a velocidade
de reacção. Foi aprovado com a classificação mais baixa, já que
a teoria desconhecida era tão inovadora que ninguém a sabia classificar-
nem os Químicos nem os Físicos a reconheciam como pertencente
a assas áreas especificas ( na verdade esta teoria constitui uma
ponte entre a Física e a Química). Arrhenius enviou cópias da
tese a um número de cientistas proeminentes entre os quais Rudolf
Clausius (Bonn), Lothar Meyer (Tubingen), Ostwald (Riga) e van't
Hoff (Amsterdam). Ostwald ficou muito impressionado com o trabalho
e ofereceu-lhe um lugar de Assistente na sua Universidade, iniciando
Assim uma colaboração e uma amizade enriquecedoras. Pelas suas
contribuições científicas, recebeu algumas medalhas: Medalha Davy
(1902), Medalha Faraday (1914), Medalha Willard Gibbs (1911),
e também o Prémio Nobel da Química em 1903.
Publicou um trabalho no qual mencionava que a presença de ácido
carbónico influenciava a temperatura da Terra. Essa teoria actualmente
é denominada de " efeito de estufa".
Svante Arrhenius (1859-1927).
Teoria: Presença de iões em soluções ácidas e básicas.
Soluções Ácidas
O cloreto de hidrogénio, HCl (g), quando dissolvido em água, origina
uma solução ácida. Essa solução é vulgarmente designada por ácido
clorídrico HCl (aq).
Quando se dissolve cloreto de Hidrogénio em água dá-se uma reacção
química de acordo com a seguinte equação.
HCl(g)+H2O(l) --> H3O+(aq) + Cl-(aq)
A reacção é praticamente completa. Logo, o equilíbrio encontra-se
fortemente deslocado no sentido dos produtos, H3O+(aq) e Cl-(aq).
Formam-se iões hidrónio, e cloreto. O ião HIdrónio encontra-se
presente em todas as soluções ácidas. É o ião responsável pelas
propriedades ácidas da solução. Quanto maior for a sua concentração,
mais ácida é a solução.
Soluções básicas
Já vimos que o carácter ácido é devido á presença de iões H3O+
na solução. Uma solução básica deve ter iões que diminuam a concentração
destes iões hidrónio.
Quando se dissolve hidróxido de sódio na água, dá-se a dissociação
dos iões, de tal modo que estes se misturam intimamente com
a água.
NaOH(s) +aq --> Na+(aq) + OH-(aq)
O carácter básico da solução de hidróxido de sódio é devido ao
ião hidróxido OH-(aq).
Solução de ácido com base
Afirmámos que o carácter ácido de uma solução está relacionado
com a presença de iões hidrónio, H3O+(aq) , e que o carácter básico
é devido á presença de iões, OH-(aq) .
A reacção entre estes dois iões origina moléculas de água de
acordo coma seguinte equação:
OH(aq) + H3O (aq) --> 2H2O(l)
Os iões hidróxido e hidrónio neutralizam-se mutuamente, originando
moléculas de água.
Einstein, Albert (1879-1955)
Físico alemão de origem judaica, natural de Ulm. Aos dezasseis
anos emigrou com os pais para Milão, mas em 1901, naturalizou-se
suíço. Quatro anos depois obtém o grau de Doutor pela Universidade
de Zurique. De 1913 a 1933 vive na Alemanha, onde exerce a actividade
de investigador e professor.
Em 1921 recebe o Prémio Nobel da Física, elaborada que fora a
teoria da relatividade. Abandona a Alemanha devido à ascensão
do nazismo, instala-se nos EUA, onde passa a dirigir o Instituto
de Estudos Superiores de Princeton, naturalizou-se americano
em 1940.
Um ano antes avisara a presidente Roosevelt sobre a possível obtenção de armas nucleares pela Alemanha. Considerado o Maior sábio do século XX, e a sua obra de Física Matemática constitui um ponto de profunda viragem na ciência contemporânea. A famosa teoria da relatividade foi elaborada em duas etapas. a Primeira, publicada em 1905, é a teoria da relatividade restrita: modifica os conceitos de espaço e de tempo da física Newtoniana e introduz a equivalência entre massa e energia, que considera dois aspectos da mesma realidade. A segunda, de 1916, é a da teoria geral da relatividade: estabelece então um novo conceito de gravitação dentro da relatividade espacial e concebe o universo como quadrimensional, homogéneo, curvo, finito e em expansão. Estas hipóteses puderam ser confirmadas tanto atómica como astronomicamente. Em 1950, publica ainda a teoria do campo unitário, que estabelece a síntese dos campos electromagnético e gravítico. Interessado na teoria dos Quanta de Max Planck, desenvolveu-a até chegar à explicação do efeito fotoeléctrico e suas leis. Pacifista convicto, Einstein participou em diversas manifestações contra o uso de armas nucleares, pretendendo mesmo que os projectos sobre energia nuclear ficassem sujeitos a vigilância internacional. Morreu em Princeton, deixando, ainda, publicados um livro de poesia e uma memória Sobre o problema Cosmológico.
Bohr, Niels Henrik (1885-1962)
Físico dinamarquês que, aplicando ao átomo a teoria dos quanta, estabeleceu a representação electrónica planetária do átomo de Rutherford(1913), o que veio a permitir a interpretação de inúmeros fenómenos. Os seus estudos contribuíram para a descoberta da energia nuclear e para o fabrico da bomba atómica. Foi condecorado com o Prémio Nobel da Física em 1922. Galardoado com o Prémio Nobel da Física em 1975, juntamente com Benjamin Mottelson e James Rainwater.
Teoria: Modelo atómico de Bohr
Bohr aproveitou o modelo proposto por Rutherford.
Rutherford afirmava que a maior parte do átomo é espaço vazio, e que o átomo era quase totalmente de carga positiva, e que esta se encontrava concentrada na região do núcleo do átomo e por sua vez na região do espaço exterior ao núcleo é ocupada pelos electrões, os quais se movem em torno do núcleo.
Bohr aproveitou o modelo de Rutherford e fez estudos sobre o átomo
de Hidrogénio, elaborando em seguida a sua teoria.
Na sua teoria, Bohr afirmava que, os electrões moviam-se em
orbitas circulares bem definidas, em torno do núcleo, e a cada
órbita correspondia um valor de energia potencial para o sistema
electrão-núcleo. O nível de energia dos electrões correspondia
aos níveis energéticos da órbita, ou seja, os electrões com maior
energia ocupavam órbitas mais afastadas do núcleo, e, electrões
com menor energia, ocupavam lugares mais próximos do núcleo. Quando
o electrão se movia na sua órbita não havia absorção nem emissão
de energia, mas quando um electrão transitava de uma órbita para
outra, ocorria absorção ou emissão de energia.
Quando um átomo recebe energia, (por exemplo uma descarga eléctrica).
Um electrão pode transitar de uma órbita para outra mais afastada
do núcleo. Este estado é instável para o átomo e designa-se por
estado excitado.
Quando o átomo liberta a energia inicialmente recebida, o electrão
regressa novamente à órbita inicial. Esta libertação de energia
dá-se sob a forma de radiação. O átomo atinge o estado de energia
mínima ou estado fundamental.
Bohr caracterizou cada nível de energia por um número natural
(1,2,3,4...), mas que também podem ser designados por camadas
k, L, M, N, etc.
Bibliografia:
Santos, A.M. Nunes dos; Teodoro, Vítor Duarte; QUÌMICA 10º ano;
Didáctica Editora.
Corrêa, Carlos; Basto, Fernando Pires; Química 12º ano; Volume
I E II; Porto Editora.
Faria, Ana Maria; Teodoro, Vítor Duarte; FQ 8 Química e Física;
Didáctica Editora.
Dias, Fernando ; Rodrigues, M. Margarida; O mundo da QUÍMICA
2; Edições ASA.
Corrêa, Carlos; Nunes, Adriana; QUÍMICA 10º; Porto Editora.
Correa, Mário Dias; NOVA ANCICLOPÉDIA PORTUGUESA; Volumes:1,2,3,4,5,6,7,8,10,13,15,17,
21, 26.î; Ediclube.
Vítor Miranda e Jorge Macedo
(12º Ano - Esc.Sec.Barcelinhos)